Гепарин в живот для чего после кесарева
Гепарин уколы : инструкция по применению
Лекарственная форма
Раствор для инъекций, 5000 МЕ/мл
Состав
1 мл раствора содержит
активное вещество: гепарин натрия 5000 МЕ,
вспомогательные вещества: бензиловый спирт – 9,0 мг, натрия хлорид, вода для инъекций.
Описание
Бесцветная или светло-желтого цвета прозрачная жидкость
Фармакотерапевтическая группа
Препараты, влияющие на кроветворение и кровь. Антикоагулянты прямые. Гепарин.
Фармакологические свойства
Фармакокинетика
После подкожного введения ТCmax- 4-5 ч. Связь с белками плазмы крови – до 95 %, объем распределения очень маленький – 0,06 л/кг (не покидает сосудистое русло из-за сильного связывания с белками плазмы крови). Гепарин не проникает через плаценту и в грудное молоко. Интенсивно захватывается эндотелиальными клетками и клетками мононуклеарно-макрофагальной системы (клетками ретикуло-эндотелиальной системы), концентрируется в печени и селезенке. При ингаляционном способе введения (вдыхании) поглощается альвеолярными макрофагами, эндотелием капилляров, больших кровеносных и лимфатических сосудов: эти клетки являются основным местом депонирования гепарина, из которого о постепенно высвобождается, поддерживая необходимую концентрацию в плазме крови.
Метаболизируется в печени с участием N-десульфамидазы и гепариназы тромбоцитов, включающейся в метаболизм гепарина на более поздних этапах. Участие в метаболизме тромбоцитарного фактора IV (антигепаринового фактора), а также связывание гепарина с системой макрофагов объясняют быструю биологическую инактивацию и кратковременность действия. Десульфатированные молекулы под воздействием эндогликозидазы почек превращаются в низкомолекулярные фрагменты. Период полувыведения гепарина – 1-6 ч (в среднем – 1,5 ч); увеличивается при ожирении, печеночной и/или почечной недостаточности; уменьшается при тромбоэмболии легочной артерии, инфекциях, злокачественных опухолях. Выделяется почками, преимущественно в виде неактивных метаболитов, и только при введении высоких доз возможно выведение (до 50 %) в неизмененном виде. Не выводится посредством гемодиализа.
Фармакодинамика
Антикоагулянт прямого действия, относится к группе среднемолекулярных гепаринов, замедляет образование фибрина. Антикоагулянтный эффект обнаруживается in vitro и in vivo, наступает непосредственно после внутривенного применения.
Механизм действия гепарина основан прежде всего на связывании его с антитромбином III – ингибитором активированных факторов свертывания крови: тромбина, IXа, Xа, XIа, XIIа (особенно важной является способность ингибировать тромбин и активированный фактор Х). Гепарин нарушает переход протромбина в тромбин, угнетает тромбин и останавливает образование фибрина из фибриногена, а так же в некоторой степени уменьшает агрегацию тромбоцитов.
Увеличивает почечный кровоток; повышает сопротивление сосудов мозга, уменьшает активность мозговой гиалуронидазы, активирует липопротеинлипазу и обладает гиполипидемическим действием.
Гепарин снижает активность сурфактанта в легких, подавляет чрезмерный синтез альдостерона в коре надпочечников, связывает адреналин, модулирует реакцию яичников на гормональные стимулы, усиливает активность паратгормона. В результате взаимодействия с ферментами может увеличивать активность тирозингидроксилазы мозга, пепсиногена, ДНК-полимеразы и снижать активность миозиновой АТФазы, пируваткиназы, РНК-полимеразы, пепсина.
У больных с ишемической болезнью сердца (в комбинации с ацетилсалициловой кислотой) снижает риск развития острых тромбозов коронарных артерий, инфаркта миокарда и внезапной смерти. Уменьшает частоту повторных инфарктов и летальность больных, перенесших инфаркт миокарда.
Дефицит антитромбина III в плазме или в месте тромбоза может снизить антитромботический эффект гепарина.
Показания к применению
— лечение тромбоэмболических нарушений, таких как тромбоз глубоких вен, острая артериальная эмболия или тромбоз, тромбофлебит, эмболия коронарных сосудов
— профилактика тромбоза глубоких вен
— профилактика тромбоэмболии коронарных артерии у больных подверженных данной патологии
— профилактика свертывания крови во время операций с использованием экстракорпоральных методов кровообращения, при проведении гемодиализа
Способ применения и дозы
ГЕПАРИН назначать в виде струйных или прерывистых внутривенных или подкожных инъекций. Перед назначением препарата следует определить время свертывания крови, тромбиновое и активированное парциальное тромбопластиновое время, количество тромбоцитов. Для разведения ГЕПАРИНА использовать только 0,9 % раствор натрия хлорида.
Взрослым при остром тромбозе лечение начинать с внутривенного введения 10000 – 15000 МЕ ГЕПАРИН под контролем свертываемости венозной крови, тромбинового и активированного парциального тромбопластинового времени. После этого по 5000 – 10000 МЕ ГЕПАРИНА вводить каждые 4-6 часов. При этом адекватной считается доза ГЕПАРИНА, при которой время свертывания крови увеличивается в 2,5-3 раза, а активированное парциальное тромбопластиновое время – в 1,5-2 раза.
Для профилактики острого тромбоза ГЕПАРИН вводить подкожно по 5000 МЕ каждые 6-8 часов. При первой фазе синдрома диссеминированного внутрисосудистого свертывания крови (ДВС) у взрослых гепарин назначать подкожно длительное время в суточной дозе 2500-5000 МЕ под контролем тромбинового времени. За 1-2 суток до отмены ГЕПАРИНА суточную дозу постепенно снижать.
Непрерывная внутривенная инфузия является наиболее эффективным способом применения гепарина, лучшим, чем регулярные (периодические) инъекции, так как обеспечивает более стабильную гипокоагуляцию и реже вызывает кровотечения.
При проведении экстракорпорального кровообращения вводят в дозе 140- 400 МЕ/кг или по 1500-2000 МЕ на 500 мл крови. При гемодиализе вначале вводят внутривенно 10000 МЕ, затем в середине процедуры – еще 30000-50000 МЕ. Для лиц пожилого возраста, особенно женщин, дозы должны быть снижены.
Детям ГЕПАРИН вводят внутривенно капельно: от 3 до 6 лет – 600 МЕ/кг в сутки, от 6 до 15 лет – 500 МЕ/кг в сутки под контролем АЧТВ.
Побочные действия
Наиболее частые побочные явления – кровотечение, обратимые изменения
активности печеночных ферментов, обратимая тромбоцитопения и различные кожные реакции. Имеются отдельные сообщения о генерализованных аллергических реакциях, некрозе кожи и приапизме.
ГЕПАРИН может вызвать тромбоцитопению напрямую или опосредованно
путем выработки тромбоцит-агрегирующих антител. Эти явления обратимы после отмены препарата.
тромбоцитопения тип I
Тромбоцитопения тип II, вероятно иммуноаллергической природы. В некоторых случаях тромбоцитопения типа II сопровождается венозной или артериальной тромбозами.
— артериальные тромбозы, сопровождающиеся развитием гангрены, инфаркта миокарда, инсульта
— кальцификация мягких тканей
— остеопороз, спонтанные переломы костей
— увеличение активности «печеночных» трансаминаз
— ангионевротический отек и анафилактоидные реакции
Низкомолекулярные гепарины в лечении и профилактике осложнений послеродового периода при абдоминальном родоразрешении
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
Цель исследования. Совершенствование профилактики воспалительных и тромботических осложнений с использованием НМГ после операции кесарева сечения у родильниц с факторами умеренного риска развития тромбоза.
Материал и методы. 51 родильница с профилактическим использованием низкомолекулярных гепаринов (НМГ), составившая основную группу, и 60 родильниц (группа сравнения) без использования НМГ. Всем пациенткам проводилось исследование общеклинических и гемостазиологических показателей, определение в сыворотке крови концентраций про- и противовоспалительных цитокинов, эндотоксина, а также допплерометрическое исследование сосудов послеродовой матки.
Результаты. Профилактическое применение НМГ после абдоминального родоразрешения у женщин группы умеренного риска развития тромботических осложнений способствует нормализации гемостатического и воспалительного потенциала крови.
Заключение. Профилактическое применение НМГ после абдоминального родоразрешения у женщин группы умеренного риска развития тромботических осложнений способствует более благополучному течению пуэрперия.
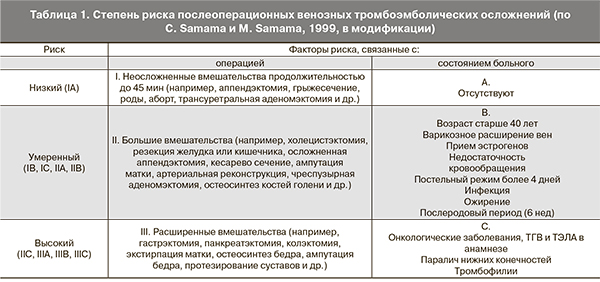
Во многих странах в последние десятилетия отмечается значительный рост тромбоэмболических осложнений при различных заболеваниях, в том числе при патологическом течении беременности, в родах и послеродовом периоде [1, 2]. По данным А.П. Момота, до 50% всех венозных тромбоэмболических осложнений (ВТЭО), возникающих у женщин в возрасте до 40 лет, связаны с гестационным процессом [3]. Доказано, что венозные тромбозы с одинаковой частотой развиваются во время беременности и в послеродовом периоде, тогда как тромбоэмболия легочной артерии (ТЭЛА) наиболее часто наблюдается после родоразрешения [4]. Частоту венозных тромбозов бывает трудно оценить, так как тромбоз глубоких вен (ТГВ) в 38%, а ТЭЛА – в 22% случаев развивается уже после выписки пациентки из акушерского стационара [5]. Развитие венозного тромбоэмболизма потенцируется рядом факторов: кесарево сечение (КС) (особенно экстренное), ожирение, сердечно-сосудистые заболевания, курение, варикозное расширение вен, текущая инфекция, иммобилизация больше 4 дней, носительство отдельных протромботических генов тромбофилии, которые традиционно относят к факторам умеренного риска развития тромботических осложнений [6, 7]. Их взаимодействие приводит к значительному снижению адаптационных способностей организма женщины и может стать своего рода «триггером» в каскаде патологических реакций развития генерализованной микроангиопатии и тромбофилии. Поэтому у женщин, имеющих сочетание этих факторов, имеется риск патологического течения беременности, родов, а также послеродового периода.
Для оценки степени риска развития ВТЭО применяют модифицированную классификацию С. Samama и M. Samama (табл. 1).
В последнее время все больше данных свидетельствует о связи тромботических и воспалительных процессов [8, 9]. Возможно, это является свидетельством того, что, несмотря на широкое внедрение антибиотикопрофилактики и антибиотикотерапии, воспалительные осложнения пуэрперия не стали «болезнью прошлого» и ежегодно фиксируются у тысяч родильниц. Ряд исследователей отмечают, что отличительной особенностью течения послеродовых воспалительных осложнений являются стертые клинические процессы, которые не соответствуют глубине морфологических изменений и не отражают тяжесть состояния родильницы [10–12]. Так, стертая форма метроэндометрита без яркой манифестации встречается в современных условиях чаще (80%), чем классическая (20%) и имеет ряд особенностей, которые необходимо учитывать при диагностике этой патологии [13]. Это определяет подходы к терапии и профилактике осложнений пуэрперия, предусматривающие применение препаратов, изначально нормализующих функции свертывающей системы крови, в частности НМГ. Однако на сегодняшний день нет единого мнения относительно противовоспалительного действия НМГ. Поэтому, несмотря на выяснение некоторых механизмов патогенеза патологических состояний в акушерстве, вопросы разработки эффективных и оптимальных методов терапии и профилактики возникающих осложнений послеродового периода, особенно в ситуациях сочетания факторов умеренного риска тромбоза, продолжают оставаться открытыми.
Цель исследования: совершенствование профилактики воспалительных и тромботических осложнений с использованием НМГ после операции кесарева сечения у родильниц с факторами умеренного риска развития тромбоза.
Материал и методы исследования
Нами проведен анализ клинического течения послеродового периода у 111 родильниц после абдоминального родоразрешения с дополнительными факторами умеренного риска тромботических осложнений, которых выборочно разделили на две группы: I (основная) – 51 родильница, в комплекс терапии которым был включен эноксапарин натрия, II (группа сравнения) – 60 родильниц, которые не получали НМГ. После одобрения этическим комитетом и получения информированного согласия, родильницам основной подгруппы, через 12 ч после абдоминального родоразрешения с целью профилактики воспалительных и тромботических осложнений вводили эноксапарин натрия в дозе 40 мг в сутки в течение 3 дней. В ходе исследования наряду с общеклиническими и гемостазиологическими п.
Послеродовая тромбопрофилактика низкомолекулярными гепаринами
У женщин с общими факторами риска (например, ожирение, возраст старше 40 лет, кесарево сечение) абсолютный риск ВТЭ составляет 0,2% или меньше, а моделирование оценки риска показывает очень низкую положительную прогностическую ценность (0,13%). 800 женщин из группы высокого риска обречены на ВТЭ без должной тромбопрофилактики, и степень, в которой низкомолекулярный гепарин может предотвратить эту ВТЭ, неизвестна. Ни одна модель оценки риска не была клинически подтверждена, и нет когортных или экспериментальных доказательств того, что профилактика низкомолекулярным гепарином приносит пользу большинству женщин, которые критериально подходят для назначения медикаментозной тромбопрофилактики. Рекомендации Американского колледжа акушеров и гинекологов (ACOG) и Американского общества гематологов являются заметными исключениями из этой тенденции. Отмечая недостаточные доказательства, в руководствах рекомендации относительно низкомолекулярного гепарина ограничиваются женщинами с историей ВТЭ или тромбофилией высокого риска, у которых риск ВТЭ составляет 2–5%. Доля женщин, которым разрешено лечение низкомолекулярным гепарином после кесарева сечения, согласно рекомендациям Американского общества гематологов и ACOG, составляет менее 1% по сравнению с 73%, согласно рекомендациям Соединенного Королевства.
Материалы и методы
Польза и вред низкомолекулярного гепарина были оценены до и после внедрения типичной модели оценки риска в когорте из 24 000 женщин, что сделало это исследование первым, обладающим достаточной статистической мощностью для измерения небольших различий в частоте ВТЭ, кровотечений и раневых осложнений. Женщины с тромбофилией высокого риска или анамнезом предшествующей ВТЭ были исключены.
Доля рожениц, получающих низкомолекулярный гепарин, увеличилась с 1,2% до 15,6%.
Это лучшее из имеющихся доказательств реальной эффективности акушерской модели оценки риска.
Оценка риска производится в едином центре с полными данными электронной медицинской карты, качество данных высокое.
Рис. 1. Коэффициент прямой материнской смертности за трехлетний период, Соединенное Королевство, 2006–2011 гг..; перекрытие 2012–2018 гг. Данные NPEU. Спасение жизней, улучшение ухода за матерями: извлеченные уроки для информирования об охране материнства из Конфиденциальных запросов Великобритании и Ирландии о материнской смертности и заболеваемости, 2016–18 гг. По состоянию на 29 июля 2021 г. npeu.ox.ac.uk/mbrrace-uk/reports Kotaska. Послеродовая гепариновая тромбопрофилактика. Акушерский гинеколь 2021.
В эпоху доказательной медицины примечательно то, что профилактика низкомолекулярным гепарином получила широкое распространение без измерения чистой пользы или вреда.
Сторонники либеральной тромбопрофилактики заявляют, что рандомизированные исследования невозможны
Поскольку польза от низкомолекулярного гепарина настолько мала, требуемый размер выборки огромен
В то же время клиницисты заявляют, что риск ВТЭ настолько велик, что широкое применение низкомолекулярного гепарина оправдано.
Применение низкомолекулярных гепаринов в акушерской практике
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
Д о настоящего времени тромбозы и тромбоэмболические осложнения остаются основной причиной смерти в большинстве развитых стран. Только в США от артериальных и венозных тромбозов ежегодно погибает около 2 млн человек и приблизительно такому же числу больных ежегодно удается пережить эпизоды глубоких венозных тромбозов, тромбоэмболий, цереброваскулярных тромбозов, транзиторных ишемических атак, коронарных тромбозов, тромбозов сетчатки и т.д. Даже от злокачественных новообразований погибает приблизительно в четыре раза меньше больных. Это свидетельствует о том, что тромбозы являются экстраординарной причиной заболеваемости и смертности населения, в том числе и материнской. По обобщенным данным мировой литературы, на 1000 родов приходится 2-5 тромботических осложнений. 50% всех венозных тробмоэмболических осложнений возникают у женщин в возрасте до 40 лет и, как правило, они связаны с беременностью.
| На 1000 родов приходится 2-5 случаев тромботических осложнений. |
Таким образом, тенденция к стазу крови в сочетании с гиперкоагуляцией создает условия, благоприятствующие повышенному риску тромбообразования.
Дополнительными факторами риска по тромботическим осложнениям могут служить возраст (старше 35 лет), сердечно-сосудистая патология, эндокринные нарушения, гестоз, заболевания почек, гнойно-септические заболевания, а также ряд острых состояний (отслойка плаценты, эмболия околоплодными водами, длительная задержка мертвого плода в матке и др.). Гиперкоагуляция сменяется внутрисосудистым свертыванием крови, проявляющимся различными формами синдрома диссеминированного внутрисосудистого свертывания (ДВС).
Следует отметить, что расширение показаний к кесареву сечению также сопряжено с повышенным риском тромбоза вследствие хирургического вмешательства, значительного изменения метаболизма, травмы, попадания тромбопластических субстанций в кровоток, иммобилизации, замедления венозного кровотока и пр.
Особое место среди факторов риска по тромбоэмболическим осложнениям занимают гнойно-септические процессы в области малого таза, так как в патологический процесс вовлекаются подвздошные, яичниковые, маточные вены, что может осложниться бактериальной легочной эмболией. При этом повышенная концентрация высокодисперсных белков плазмы (в частности, фибриногена) дополнительно опосредует повышенную структурную гиперкоагуляцию.
За последнее десятилетие клиническая картина обогатилась возможностями выяснения ряда ранее не известных патогенетических форм тромбоза: иммунных, а также генетических или так называемых наследственных дефектов гемостаза, предрасполагающих к тромбозу.
К иммунным формам относят тромбоз, обусловленный гепарин-индуцированной тромбоцитопенией (ГИТ), тромбоз, связанный с циркуляцией антифосфолипидных антител при антифосфолипидном синдроме, а также сравнительно недавно открытую новую форму иммунного тромбоза, обусловленного аутоантителами к фактору Виллебранда. При всех иммунных тромбозах независимо от генеза происходит внутрисосудистая агрегация тромбоцитов.
В последние годы значительно изменился взгляд на патогенез иммунных тромбозов. Если предыдущие концепции сводились к ингибиции патофизиологически важных естественных антитромботических агентов (антигенов) антителами, то в настоящее время основную роль отводят связыванию антител через различные протеины с клетками крови (тромбоциты и др.) или мембраной эндотелиальных клеток с последующей активацией протромботических механизмов этими клетками через их FcgRII-рецепторы или через комплементарный каскад.
Наиболее изученными на сегодняшний день считаются механизмы возникновения гепарининдуцированной тромбоцитопении и тромбоза, обусловленного ГИТ.
Различают 2 типа ГИТ: наиболее частый I тип имеет раннее начало, сопровождается легкой тромбоцитопенией, возможно, связанной со способностью фракций гепарина (в основном нефракционированного), не обладающих антикоагулянтной активностью, усиливать небольшую активность тромбоцитов; тип II обусловливает спорадические, изолированные случаи тяжелой тромбоцитопении с поздним началом, иммуноспровоцированные и часто ассоциирующиеся с катастрофическим тромбозом.
В основе лечения тромбофилических состояний и ДВС-синдрома лежит устранение непосредственной причины их возникновения (например, антибиотикотерапия при гнойно-септических процессах), а также воздействие на основные звенья патогенеза. Целый ряд состояний в акушерстве диктует необходимость проведения профилактических мер.
Показания к профилактике тромбоэмболических осложнений во время беременности и в послеродовом периоде:
• беременные в возрасте старше 35–40 лет
• беременные с экстрагенитальной патологией, особенно с заболеваниями сердечно-сосудистой системы и почек
• повторнобеременные с отягощенным акушерским анамнезом (гнойно-септические заболевания, антенатальная гибель плода, задержка развития плода, нефропатия, преждевременная отслойка нормально расположенной плаценты)
• наличие в анамнезе тромбозов и тромбоэмболий
• беременные, которым показана операция при беременности
• осложненное течение беременности, родов и послеродового периода: (нефропатия, преждевременная отслойка нормально расположенной плаценты, эмболия околоплодными водами, гнойно-септические заболевания, массивные гемотрансфузии)
• острые тромбозы и тромбоэмболии
• генетические формы тромбофилии.
Критериями противотромботической терапии в акушерской практике являются ее эффективность и безопасность для матери и плода. Из всего арсенала противотромботических средств (непрямые и прямые антикоагулянты, антиагреганты, тромболитики) препаратами выбора были и остаются гепарин натрий и его производные. В акушерской практике гепарин натрий занимает особое место в связи с немедленным антикоагулянтным эффектом, существованием антидота, легкостью управления дозой, отсутствием тератогенного и эмбриотоксического эффектов. Непрямые антикоагулянты проходят через плаценту и обладают тератогенным и эмбриотоксическим эффектами. В исключительных случаях их применение ограничено II триместром беременности, когда органогенез завершен.
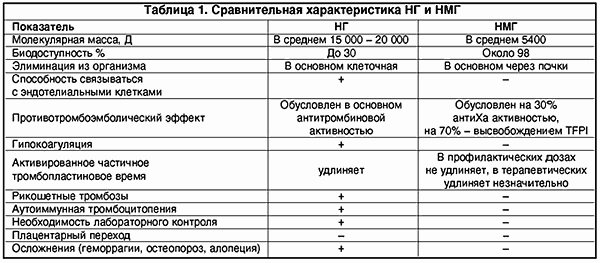
Однако, несмотря на множество преимуществ, обычный нефракционированный или высокомолекулярный гепарин обладает рядом нежелательных побочных свойств, которые в основном предопределены его структурой. Нефракционированный гепарин (НГ) представляет собой смесь кислых макромолекулярных цепей сульфатированных анионов мукополисахаридов с высоковариабельной молекулярной массой от 4000 до 40 000 Д.
Вследствие гетерогенности структуры НГ имеет биодоступность лишь 30%, так как связывается с множеством белков, клеток (макрофаги, клетки эндотелия и т.д.). Кроме того, НГ подвержен влиянию антигепаринового фактора тромбоцитов (фактор IV), образуя комплекс гепарин-фактор. Это чревато возникновением гепариновой иммунной тромбоцитопении в результате образования антител к этому комплексу (наиболее опасная форма тромбоза).
Одним из нежелательных эффектов гепарина натрия является истощение АТ III при длительном его применении в больших дозах, что также может вызвать состояние гиперкоагуляции и стать причиной тромбоза. Понятно, что увеличение дозы гепарина натрия в такой ситуации не приводит к антикоагулянтному эффекту.
Последние 5-7 лет в клиническую медицину активно внедряются низкомолекулярные гепарины (НМГ), зарекомендовавшие себя с лучшей стороны, так как в большинстве случаев проявляют большую противотромботическую активность и достоверно гораздо более низкую выраженность геморрагических осложнений и других побочных эффектов.
НМГ получают путем деполимеризации НГ, их молекулярная масса колеблется в пределах от 4 до 8 кД. Деполимеризацию можно осуществить химическим, ферментным и физическим методом (g-излучение).
Изменение структуры молекулы гепарина, т.е. уменьшение молекулярной массы почти в 3 раза, повлекло за собой и изменения фармакодинамики и фармакокинетики. НМГ имеют более высокую биодоступность, чем НГ (около 98%), больший период полужизни. НМГ меньше связываются с различными белками, клетками. В отличие от НГ их почечный клиренс значительно преобладает над клеточным (что важно учитывать у больных с почечной недостаточностью). Кроме того, НМГ в гораздо меньшей степени, чем НГ, связываются с клетками эндотелия, что также обеспечивает длительную циркуляцию в плазме (в 2-4 раза дольше).
НМГ не обладают антитромбиновым свойством и, следовательно, не вызывают гипокоагуляции. Противотромботический эффект НМГ в основном зависит от его влияния на фактор Ха.
Однако если в состав НМГ входят фракции с молекулярной массой более 5400 Д, что эквивалентно более чем 18 дисахаридным остаткам, то также проявляется анти-IIa-активность. Так, у одного из наиболее ранних НМГ, надропарина кальция, молекулярная масса которого в среднем 4500 Д, благодаря фракциям с молекулярной массой больше 5400 Д соотношение анти-IIa- и анти-Ха-активности равно 1:4.
НМГ способствуют также активации фибринолиза путем освобождения из эндотелия тканевого активатора плазминогена t-PA; кроме того, они меньше подвержены действию антигепаринового фактора IV тромбоцитов и, соответственно, реже вызывают гепариновую иммунную тромбоцитопению.
Прогресс в области гемостазиологии показал, что в генезе большинства тромботических явлений огромную роль играют активация внешнего пути свертывания и выделение в кровь тканевого фактора (ТФ). Этот механизм преобладает во время беременности, в перинатальном, послеоперационном периодах, при гнойно-септических заболеваниях, антифосфолипидном синдроме (АФС), ожирении, онкологических и множестве сердечно-сосудистых заболеваний, а также при ряде связанных с ними состояний: пороках сердца, кава-фильтре, чрескожной транслюминальной коронарной ангиопластике, тромбоэмболии легочной артерии, дистресс-синдроме легких, отслойке плаценты, эмболии околоплодными водами и др.
TFPI-фактор, или липопротеин-ассоциированный ингибитор коагуляции (LACI-фактор), является мощным естественным ингибитором внешнего пути свертывания. НМГ способны значительно повышать его уровень в крови. TFPI-фактор контролирует обусловленный фактором Ха механизм отрицательной обратной связи и ингибирует ряд комплексов, которые через образование протромбиназы ведут к генерации тромбина и затем фибрина.
TFPI имеет и другие фармакологические свойства, как потенциальное антитромботическое средство: это ингибитор образования протеаз, прямой ингибитор фактора Ха и эластазы, ингибитор, обусловленный ТФ активации тромбоцитов и макрофагов; он взаимодействует с липопротеинами низкой плотности с изменением их патогенетической роли (особенно при атеросклерозе), взаимодействует с эндотелием сосудов, обеспечивает модуляцию эндогенных гликозаминогликанов, нейтрализует эндогенно образующийся ТФ.
В нормальных физиологических условиях TFPI синтезируется в микроваскулярном эндотелии и в небольших количествах мегакариоцитами и макрофагами и не синтезируется нормальными гепатоцитами или эндотелием крупных сосудов. Незначительные количества TFPI исходят из фибробластов, но при активации этих клеток уровнь TFPI повышается в 6-8 раз.
Возвращаясь к эффектам НМГ, следует отметить, что независимо от патогенетического механизма тромбозов общим для них является активация тромбинового пути, и преимуществом НМГ является их способность препятствовать образованию тромбина. Если учесть меньшую зависимость противотромботического эффекта НМГ от уровня АТ III, чем у НГ, то можно думать о применении НМГ у больных с дефицитом АТ III.
В отличие от НГ, благодаря меньшей молекулярной массе и большей биодоступности, НМГ дольше циркулируют в крови и обеспечивают продолжительный противотромботический эффект в значительно меньших суточных дозах. Возможно однократное подкожное введение препарата в сутки: препараты не вызывают образования гематом в области инъекций.
НМГ не вызывают гипокоагуляции, поскольку противотромботический эффект направлен на ингибцию Ха-фактора и внешнего пути свертывания крови; в гораздо меньшей мере подвержены влиянию антигепаринового фактора 4 тромбоцитов, соответственно крайне редко вызывают тромбоцитопению и не обусловливают иммунных тромбозов (табл. 1).
Учитывая механизм действия НМГ и результаты их применения в широкой клинической практике, большинство исследователей считают, что нет необходимости в лабораторном контроле при использовании НМГ в профилактических целях. Тем не менее оценку их антикоагулянтного эффекта можно проводить по анти-Ха-активности. Биологические методы контроля терапии НГ и НМГ с учетом их действия на различные компоненты системы гемостаза представлены в таблице 2.
До появления НМГ контроль терапии преследовал цель обеспечения адекватной дозы НГ во избежание опасных геморрагических осложнений. При применении НМГ практически не существует проблемы гипокоагуляционных эффектов. Однако, весьма актуален контроль эффективности препарата. Для этой цели можно использовать такие маркеры тромбофилии, как комплекс тромбин-антитробмин, фрагмены F1+2 протромбина и особенно продукты деградации фибрина-фибриногена. Маркеры внутрисосудистого свертывания крови и тромбофилии представлены в таблице 3.
Установление отсутствия трансплацентарного перехода НМГ открыло большие возможности широкого применения его в акушерской практике, особенно у беременных с заболеваниями сердечно-сосудистой системы, с АФС и при ряде состояний, сопровождающихся тромбофилией и внутрисосудистым свертыванием крови. Преимущественное воздействие НМГ на внешний путь свертывания крови открывает заманчивую перспективу лечения эндотелиальных изменений при гестозах.
Положительным свойством НМГ (в частности, надропарина кальция) является купирование в течение 2-3 дней ДВС-синдрома у беременных с гестозами. Как правило, это сопровождается и регрессом заболевания. Однако если основные проявления гестоза не исчезают, то терапия НМГ более 1 нед нецелесообразна. Возможно, наблюдаемый положительный эффект НМГ у беременных с начальными формами гестоза обусловлен воздействием на эндотелий. Помимо стабилизирующего влияния антиагрегантов и антикоагулянтов, НМГ препятствуют экспрессии фактора Виллебранда на эндотелии.
Раствор Фраксипарина выпускается в одноразовых шприцах по 0,3, 0,4, 0,6, 1 мл. Это удобно в применении, инъекции безболезненны и не оставляют гематом. Препарат вводят под кожу брюшной стенки, что делает возможным его применение в амбулаторных условиях.
Таким образом, применение НМГ в акушерской практике открывает новые перспективы для эффективной профилактики и лечения тромбоэмболических осложнений, заболеваний, протекающих с ДВС-синдромом, а также шока и шокоподобных состояний.