Генно инженерная векторная вакцина что значит
Что такое ДНК-вакцины и с чем их едят?
Автор
Редактор
ДНК-вакцины относятся к типу принципиально новых биологических препаратов. С их разработкой связывают большие надежды на повышение эффективности профилактики не только заболеваний бактериальной, вирусной и паразитарной природы, но и аллергических, аутоиммунных и даже онкологических болезней. Более двадцати лет назад возникла идея использовать гены возбудителей заболеваний для активации защитных механизмов. Конструкция ДНК-вакцин гениально проста: главные компоненты в ней — вектор и целевой иммуноген. Но, несмотря на это, ДНК-вакцины не стоят на страже нашего здоровья: их не вводят пациентам в поликлиниках, они не продаются в аптеках.
Более сотни лет прошло с введения Л. Пастером термина «вакцина» (лат. vacca — корова) и более двух сотен — с легендарных экспериментов Э. Дженнера по прививанию коровьей оспы ребенку с целью предупреждения развития опасного человеческого варианта болезни. Принцип защитного действия введенных в организм ослабленных инфекционных агентов или их частей научным языком объяснили уже в XX веке: безопасный чужеродный антиген учит иммунную систему в дальнейшем быстро распознавать и уничтожать активного и опасного возбудителя с точно такими же антигенами*. Процесс часто сравнивают с раздачей фоторобота преступника сотрудникам полиции.
* — Хронологию разработки вакцин, информацию о влиянии вакцинации на характер эпидемий и численность человечества, доводы адептов движения антивакцинации и ответы на множество животрепещущих вопросов относительно целесообразности, пользы и вреда прививок можно найти в статье «Вакцины в вопросах и ответах» [1]. — Ред.
За 200 лет форма и содержание прививок претерпели существенные изменения: Дженнер инфицировал царапины содержимым оспинных пустул, Пастер облагородил процедуру, вводя ослабленных агентов шприцем, затем научились создавать вакцины из убитых и даже растерзанных возбудителей (сплит- и субъединичные вакцины), недавно начали использовать рекомбинантные вакцины, содержащие один или несколько антигенов (обычно белковых), синтезированных генно-инженерным путем. И вот в двери ВОЗ робко стучится новый плод, порожденный слиянием науки с фарминдустрией, — вакцина из нуклеиновых кислот [2].
Начало ДНК-вакцинологии связывают с работами Д. Танга (1992 г.), в которых была показана способность плазмидной ДНК, экспрессирующей гормон роста человека, индуцировать выработку антител.
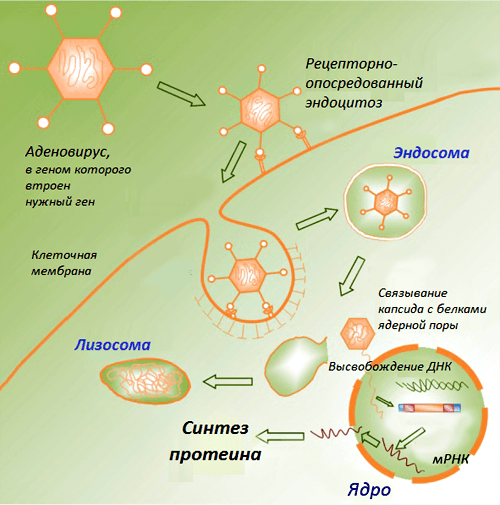
В классическом варианте такие вакцины состоят из плазмидных ДНК, содержащих гены возбудителей инфекционных заболеваний (целевые гены, или иммуногены). Продукты данных генов способны вызывать развитие защитных реакций организма, выступая в этом случае в роли антигенов. Доставку ДНК в макроорганизм первоначально осуществляли в комплексе с катионными липидами, однако эффект от введения препарата чистой нуклеиновой кислоты оказался более выраженным. Введенная в организм ДНК проникает в клеточное ядро, превращая клетку в завод по производству вакцины. Такая ДНК длительное время существует вне хромосом без репликации, транскрибируется за счет ферментов хозяйской клетки и экспрессирует соответствующие гены, продукты которых вызывают формирование иммунитета (рис. 1).
Рисунок 1. Схематическое изображение процессов в клетке после проникновения ДНК-вакцины. Рисунок из «Википедии».
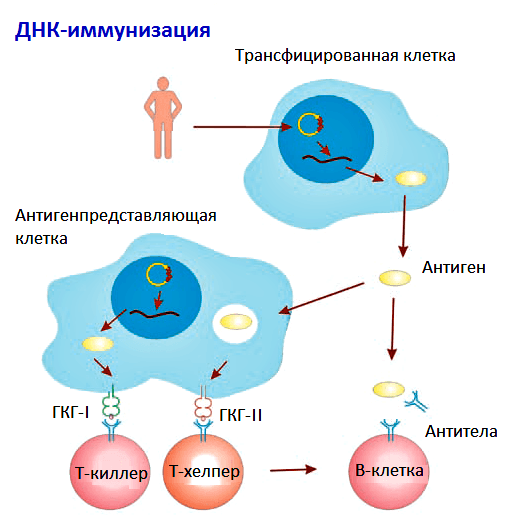
ДНК-вакцины сохраняются в организме 3–4 недели. За это время они успевают индуцировать Т- и В-клеточный иммунитет (рис. 2). Однако, несмотря на кажущуюся простоту, многие механизмы развития иммунного ответа на ДНК-вакцины остаются малоизученными [3].
Рисунок 2. Схема развития иммунного ответа на ДНК-вакцину. Рисунок из «Википедии».
Более чем 20-летняя эволюция ДНК-вакцин продолжается и сегодня. Прогресс в дизайне кодирующих антигены нуклеотидных последовательностей, в оптимизации состава (в том числе включение молекулярных адъювантов), в совершенствовании форм и физических методов доставки позволил второму поколению ДНК-вакцин преодолеть такие проблемы первого поколения, как низкий уровень трансфекции и недостаточная иммуногенность.
Сейчас разработки в области генетических вакцин проводятся во многих странах мира. В настоящее время сконструированы экспериментальные ДНК-вакцины для профилактики инфекционных заболеваний паразитарной (шистосомоз, лейшманиоз), бактериальной (хламидиоз, сибирская язва, микоплазмозы) и вирусной (бешенство, лихорадки Западного Нила и Эбола) природы. На разных стадиях доклинических и клинических испытаний находятся генетические вакцины против вирусов гриппа, гепатитов А и В, герпеса, кори, геморрагических лихорадок, ВИЧ, собачьей чумы, ящура, папилломавирусов, цитомегаловирусов. Столь интенсивное развитие данного направления вакцинологии, вероятно, уже в ближайшей перспективе обеспечит реальный выход в виде эффективных и безопасных вакцинных препаратов, рекомендованных для применения в здравоохранении и ветеринарии.
Чем же ДНК-вакцины хороши?
Но. всё хорошее имеет свои недостатки
Конструкция ДНК-вакцин
Для получения ДНК-вакцин ген, кодирующий продукцию иммуногенного белка, необходимо встроить в вектор, роль которого выполняют бактериальная плазмида или вирус [4]. Вектор не должен реплицироваться в клетках макроорганизма, поэтому может содержать только прокариотические сайты инициации репликации.
Для создания ДНК-вакцин используются хорошо изученные плазмиды грамотрицательных бактерий (в основном E. coli), в частности многокопийная pUC19 или pBR322 и их производные. Разработаны специальные векторы для ДНК-вакцин — pcDNA3 и pcDNA3.1 (Invitrogen), которые содержат цитомегаловирусный (ЦМВ) промотор и сигнал полиаденилирования гена гормона роста быка. Также к коммерчески доступным плазмидам, которые чаще всего используются в качестве векторов для ДНК-вакцин, относятся: pVAX1 (Invitrogen), pCI, VR1012 DNA, pJW4303, pVAC1-mcs и pVAC2-mcs (InvivoGen). Последние две применяются для усиления гуморального иммунного ответа и содержат антигены к поверхностным структурам мышечных клеток [5].
Из числа вирусных векторов, обеспечивающих более высокий уровень экспрессии целевого антигена, чаще всего используются: дефектный по репликации аденовирус серотипа 5 (AD5), ортопоксвирусы и модифицированные вирусы осповакцины, альфавирусы. Аденовирусный вектор обладает высокой эффективностью трансфекции — до 100 %, в него можно включать до 8 т.п.н. ДНК. Отрицательный момент — синтез собственных белков, способных индуцировать иммунный ответ. Самые используемые осповакцинные модификации — Ankara (MVA) и New York Vaccinia strain (NYVAC). Первая получена в результате 56-кратного пассирования вируса в куриных эмбриональных фибробластах. В геноме NYVAC удалено 18 открытых рамок считывания, ассоциированных с диапазоном хозяев и вирулентностью. В каждый из перечисленных векторов можно встроить до 50 т.п.н. ДНК [6].
Элементы конструктора
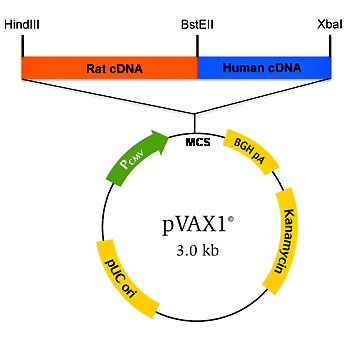
Рисунок 3. Конструкция ДНК-вакцины на основе вектора pVAX1 с химерным геном (Rat cDNA, Human cDNA). Pcmv — цитомегаловирусный промотор; MCS — сайт для множественного клонирования генов; BGH pA — терминатор с сигналом полиаденилирования гена гормона роста быка; Kanamycin — ген устойчивости к канамицину; pUC ori — участок начала репликации плазмид группы pUC; HindIII, BstEII, XbaI — сайты рестрикции. Рисунок из [5].
Чтобы пригодиться для создания ДНК-вакцин, каждый уважающий себя вектор должен содержать необходимые конструкционные элементы (рис. 3).
Службы доставки
Способам введения ДНК-вакцин в организм уделяется не меньше внимания, чем созданию самих конструкций, так как от этого зависит успех иммунизации в целом. Поэтому разработаны различные, порой весьма хитроумные, методы доставки таких вакцин в организм.
Самый простой — это парентеральный способ введения, который заключается в инъекции ДНК-вакцин в солевом растворе (внутримышечно, внутрикожно). При этом бόльшая часть ДНК поступает в межклеточное пространство и только потом включается в клетки.
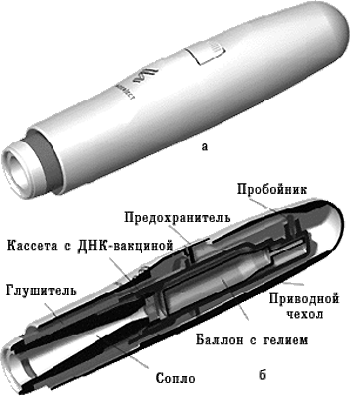
Использование генного пистолета. Для этого ДНК фиксируют на микроскопических золотых гранулах (около 1–2 мкм), а затем с помощью устройства, приводимого в действие сжатым гелием, гранулы «выстреливают» непосредственно внутрь клеток (рис. 4). Для данного способа доставки требуется значительно меньшее количество вводимого материала, чем для внутримышечной инъекции. Так, для инъекции мышам нужно 10-100 мкг препарата, а с использованием генного пистолета достаточно 0,1-1 мкг.
Электропорация — техника, которая с использованием электрических импульсов позволяет формировать поры в клеточной мембране и доставлять ДНК непосредственно в клетки.
Микроконтейнеры из полиматериалов. Московские ученые, например, создали пористую микросферу из карбоната кальция, покрытую несколькими слоями полисахаридов, в которую упаковывается молекула ДНК. Если микросферы в полимерной оболочке поместить в подкисленный раствор, карбонат кальция внутри растворится и уйдет через полимерную мембрану. Внутри останется только ДНК, подлежащая транспортировке. Подобных микроконтейнеров для доставки ДНК разработано не так много. Есть зарубежные аналоги, в которых оболочка капсулы выполнена из полимолочной кислоты. На их основе создают вакцины против гепатита и даже СПИДа. Средний диаметр микрокапсул для доставки ДНК-вакцин всего 1–2 микрона. Такие микрокапсулы можно ввести подкожно или даже в кровь. Если в микрочастицу вместе с ДНК или лекарством поместить фермент, расщепляющий оболочку капсулы изнутри, то высвобождением лекарства можно управлять: чем меньше фермента, тем медленнее рушится оболочка.
Липосомные носители обеспечивают высокую эффективность доставки при внутривенном введении, при этом экспрессия целевых генов значительно возрастает, так как осуществляется во многих органах, и особенно в селезенке.
ДНК-вакцины можно вводить перорально с использованием бактериальных носителей. Для этих целей применяются, например, модифицированные бактерии Shigella flexneri с делецией в гене asd. Мутантные бактерии растут in vitro на среде с диаминопимелиновой кислотой и, проникая в эукариотические клетки, не размножаются в них, так как отсутствует упомянутая кислота, а продуцируют закодированные в плазмиде антигены [6]. Для перорального введения создан вектор на основе ослабленного штамма Salmonella, который способен к самоуничтожению в организме через определенный период времени после выполнения иммунизационных задач. Для этого бактерию модифицировали таким образом, что ее выживание стало зависеть от наличия искусственных сахаров, не встречающихся в условиях организма. После того как в клетках, зараженных генно-инженерным штаммом Salmonella, заканчивается запас специфического сахара, поставляемого вместе с вакциной, бактерии не способны сохранить целостность своих клеточных стенок, что приводит к их гибели [11].
Была предложена оригинальная система доставки ДНК с помощью «теней» — неживых клеток грамотрицательных бактерий, лишенных цитоплазматического содержимого, но сохраняющих морфологию и антигенные структуры, включая адгезивные факторы. «Тени» обладают тропностью к антигенпрезентирующим клеткам макроорганизма и адъювантными свойствами, усиливающими иммунный ответ. Кроме того, в лиофильно-высушенном состоянии препараты «теней» хранятся при комнатной температуре неопределенно долгое время, а их производство дешево [6].
Разработана технология доставки ДНК-вакцин с использованием бактериофагов [12]. В данном случае вакцинная ДНК встраивается в геном вектора-бактериофага, которым затем иммунизируют макроорганизм [13].
Нужно учитывать, что разные методы доставки ДНК-вакцин в организм обеспечивают развитие различных клеточных реакций, при этом важные иммунологические пути могут быть стимулированы или, наоборот, не задействованы в ходе развития защитного ответа. Способы и места введения ДНК-вакцин варьируют для разных видов организмов. Например, уши свиньи — отличное место для инъекций, а вот введение препарата в уши овец или коров неэффективно.
Помощники генетических вакцин
Для усиления иммунного ответа, вызванного ДНК-вакцинами, совместно с ними вводят различные адъюванты, например, плазмиды, кодирующие синтез цитокинов, гранулоцитарно-макрофагального колониестимулирующего фактора и других костимуляторных молекул (B7.1 (CD80), B7.2 (CD86) и CD40) [14].
Для ДНК-вакцины против ВИЧ создана конструкция, которая обеспечивает получение более высокого титра антител и его сохранность в течение более длительного времени по сравнению с обычной ДНК-вакциной. Эта молекулярная вирусоподобная конструкция представляет собой частицы диаметром 25-30 нм, содержащие в центре полинуклеотидный комплекс — рекомбинантную плазмиду pGEX-2T-TBI с генами инфекционного агента ВИЧ-1 или двухцепочечную РНК, которая является стимулятором неспецифической резистентности организма. На поверхности конструкции располагаются гибридные белки, содержащие эпитопы ВИЧ-1 и фермент (например, глутатион-S-трансферазу или галактозидазу). Связь между полинуклеотидным комплексом и гибридными белками осуществляется посредством конъюгата: спермидин (для связи конъюгата с полинуклеотидным комплексом) — полиглюкин — субстрат для фермента (например, глутатион или галактопиранозид; для аффинной сорбции гибридных белков на конструкцию).
Современное состояние ДНК-вакцинологии
В настоящее время в разработке находится около 420 ДНК-вакцин против заболеваний различной этиологии как человека, так и животных.
Бόльшая часть разрабатываемых противоинфекционных терапевтических ДНК-вакцин нацелена на ВИЧ-1. Существенные успехи достигнуты в активной иммунизации против вируса папилломы человека. Некоторые вакцины находятся на стадии клинических испытаний и, возможно, в скором времени будут введены в обязательную практику. Так, американская компания Inovio, специализирующаяся на разработке ДНК-вакцин, создала препарат против цервикальной дисплазии VGX-3100, который проходит вторую фазу клинических испытаний. В 2013 г. VGX-3100 удостоилась награды «Лучшая терапевтическая вакцина» на Всемирном конгрессе по вакцинам. В I или IIа фазах клинических испытаний находятся: вакцины против гепатита С, цервикального рака, рака головы и шеи, СПИДа, гриппа. Компанией Inovio также ведется активная разработка вакцин против лихорадки Эбола* и рака простаты.
* — О более привычном, но не менее перспективном методе борьбы с вирусом Эбола — с помощью «коктейля» из моноклональных антител — читайте в статье «Вирус Эбола и макак-резус: получено новое эффективное лекарство» [15]. — Ред.
Разработке способов вакцинотерапии онкологических заболеваний при помощи рекомбинантных ДНК большое внимание уделяют и другие организации. Хорошую эффективность показала ДНК-вакцина против лейкемии, созданная в Саутгемптонском университете (но вводимая с помощью электропоратора всё той же Inovio). Вакцина направлена на подавление в организме активности гена WT1 (Wilms tumor gene). Именно повышенная активность этого гена отмечается в опухолевых клетках различных видов. В ходе I фазы клинических испытаний у пациентов наблюдалось развитие иммунного ответа, в том числе активация Т-киллеров и выработка антител; была также доказана безопасность новой вакцины. Испытания перешли в фазу II, однако из-за проблем с финансированием организаторы пока не могут увеличить число участников [16].
Животные нуждаются в такой же защите, как и люди. В связи с этим для ветеринарии разрабатываются ДНК-вакцины против бычьего и лошадиного герпесвирусов, собачьего вируса чумы, вируса классической свиной лихорадки, кроличьей папилломы, ящура, вируса инфекционного гемопоэтического некроза, вируса гриппа, вируса японского энцефалита, вируса бешенства, вируса везикулярного стоматита и т.д. [13]. Много ДНК-вакцин создается для борьбы с вирусными, бактериальными и эукариотическими патогенами рыб [17].
Активно разрабатываются ДНК-вакцины для повышения иммунитета птиц. Многокомпонентные ДНК-вакцины могут сократить количество прививок, необходимых во время короткой жизни птиц и позволят избежать риска увеличения вирулентности некоторых патогенов. В случае птицеводства проблема связана с тем, что вакцины вводятся в амниотическую жидкость яиц, которая обладает ДНКазной активностью, поэтому свойства ДНК-вакцины могут ухудшиться. Заключение ДНК в катионные липосомы, скорее всего, поможет решить эту проблему.
Из множества разработанных ДНК-вакцин на сегодняшний день лицензировано всего несколько, причем повезло в этом плане только животным (табл. 1).
Может ли вакцина или вирус встроиться в геном человека и навредить ему?
Любая прививка должна выполнять задачу формирования иммунитета для борьбы с опасной инфекцией. Однако если раньше вакцины состояли из мертвых или ослабленных микроорганизмов, то самые новые противовирусные вакцины – это сложные продукты генной инженерии.
Генетика – это наука, которая у многих людей вызывает опасения и недоверие. Сегодня мы расскажем, как на самом деле работают новейшие генные вакцины, о которых так много говорят, и могут ли они изменить ДНК человека. А также мы познакомим Вас с существом, которое действительно меняет наш генетический код.
Как в массовом сознании возникла идея возможности изменения ДНК человека путем инъекции? Все началось с фильмов о зомби-апокалипсисе и комиксов о супергероях.
История человека-паука с точки зрения науки
Многие смотрели фильм про человека-паука, который начинается с того, что студента кусает генно-модифицированный паук. После этого гены паука встроились в ДНК человека, и обычный парень получил сверхспособности – научился лазать по стенам и выпускать паутину.
Зато в новейших вакцинах есть молекулы генетического кода вируса. Давайте рассмотрим две самые передовые вакцины, о которых сегодня можно услышать из каждого утюга.
Векторная вакцина
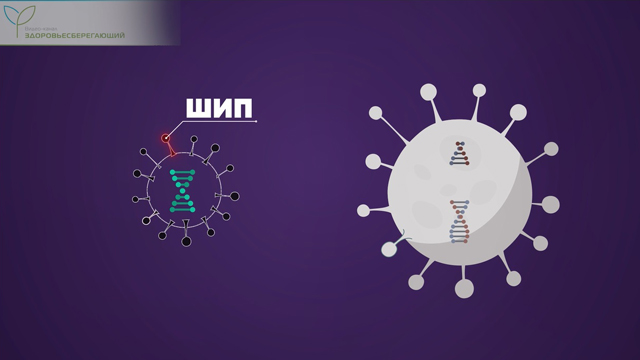
Огромное преимущество этой вакцины в том, что человеку вводят не сам опасный вирус, как это делалось раньше, а лишь маленький кусочек его генетического кода. Таким образом, вероятность заражения и тяжелых побочных эффектов практически отсутствует.
Но сам по себе этот фрагмент вирусного гена не может попасть в клетку. Поэтому его доставляют с помощью вектора.
Вектор – это другой вирус, который выполняет роль доставщика. И лучше всего с этой ролью справляется обыкновенный аденовирус, который вызывает простуду.
В процессе изготовления вакцины ДНК аденовируса подвергается двум изменениям:
После введения вакцины аденовирус проникает в клетки человека, высвобождая внутри клеточного ядра свою ДНК. Эта ДНК не может копировать сама себя и вызвать инфекцию. Вместо этого она превращает клетку в нано-фабрику по производству шипов опасного вируса.
Важно!
Шипы вируса в отсутствие самой вирусной частицы совершенно безвредны для человека.
Произведенные вирусные шипы выступают на поверхности клетки, а наш иммунитет, распознав в них чужеродный элемент, немедленно блокирует зараженную клетку и вырабатывает антитела к незнакомому белку.
Может ли аденовирусный вектор повредить ДНК человека?
По сути, аденовирусный вектор мало чем отличается от обычного аденовируса, которым в течение жизни заражаются практически все люди на Земле. А манипуляции с ДНК принципиально не меняют его поведение.
По словам Линды Кофлан, исследователя векторных вакцин из Университета Мэрилэнда, аденовирус не имеет ферментативного механизма для присоединения к человеческой ДНК. Дело в том, что две молекулы ДНК не могут объединиться сами по себе, без специального фермента. Аденовирус не обладает таким ферментом и полностью безопасен для генома человека. Именно этим обстоятельством руководствовались разработчики вакцины, выбрав аденовирус в качестве «доставщика».
А учитывая, что вектор лишен способности размножаться, в момент гибели зараженной клетки ДНК вектора поглощается и расщепляется нашими иммунными клетками. Вакцина исчезает без следа, а человек приобретает иммунитет к опасному вирусу, с которым может столкнуться в будущем.
Грегори Поланд, доктор медицинских наук из клиники Мэйо, обратил внимание на то, что изготовители вакцин всегда используют специальные культуры аденовирусов, которые классифицируются как неинтегрирующиеся. Это значит, что безопасность данных векторов для ДНК человека и животных была доказана многократными исследованиями.
Интересный факт!
По мнению ученых, именно векторные вакцины в будущем могут навсегда избавить человечество от рака и ВИЧ-инфекции.
РНК-вакцина
Чтобы понять, как она работает, необходимо знать, что такое матричная РНК.
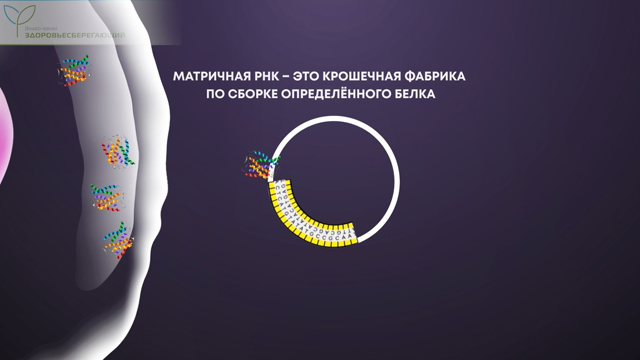
Главным компонентом таких вакцин служит матричная РНК. Эта информационная молекула является копией небольшого участка ДНК. Каждая наша клетка непрерывно создает большое количество таких информационных молекул. По сути, матричная РНК – это крошечная фабрика по сборке определенного белка, необходимого клетке. Каждый вид матричной РНК способен собирать только один вид белка.
Но когда вирус проникает в человеческую клетку, его геном производит свои собственные, вирусные фабрики, которые используют ресурсы клетки для сборки новых вирусов. Именно матричная РНК собирает те самые шипы вируса, которыми он вскрывает клеточную стенку.
Как действует РНК-вакцина?
Цель генетиков – внедрить в наши клетки матричную РНК, создающую вирусные шипы. Причем ученые создают эту молекулу искусственно, буквально собирают по крупицам, окружая каждую РНК специальной липидной оболочкой.
Благодаря липидной оболочке матричная РНК попадает в наши клетки и начинает активно производить вирусные шипы.
Далее события развиваются так же, как в случае с векторной вакциной – вирусные шипы выступают на поверхности клетки, и на них реагирует наша иммунная система.
Преимущества такого метода вакцинации огромны:
Однако есть и недостатки:
Могут ли РНК-вакцины изменить ДНК человека?
1. Матричные РНК – это естественные информационные молекулы, способные только собирать белки. Каждая такая молекула существуют всего 72 часа, после чего она распадается на части.
2. ДНК – это длинная двуцепочечная молекула, а матричная РНК состоит из одной короткой цепочки. По своей структуре матричная РНК сильно отличается от ДНК и даже теоретически не может соединиться с этой более сложной молекулой.
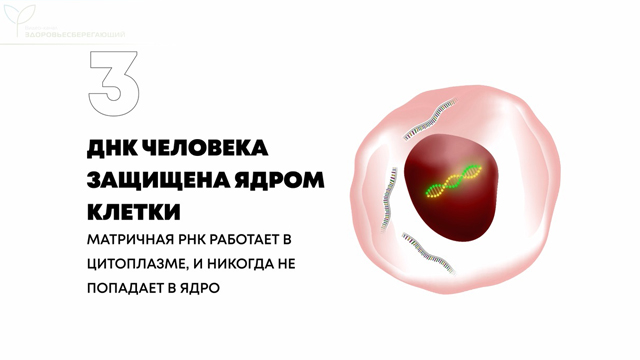
3. ДНК человека защищена ядром клетки. А матричная РНК работает в цитоплазме и никогда не попадает в ядро.
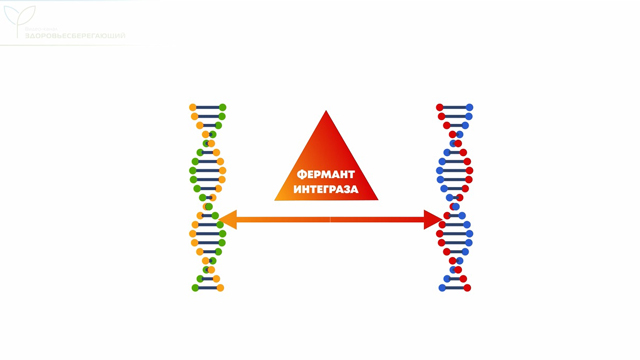
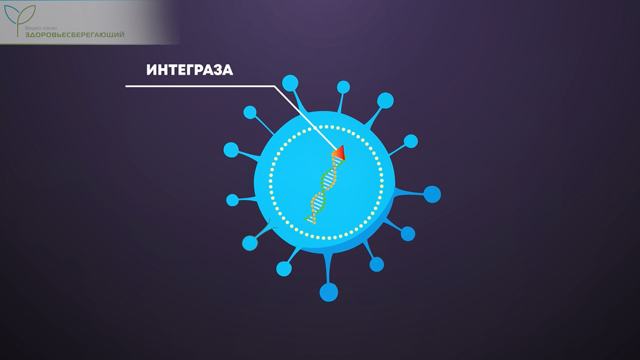
Завершая разговор о вакцинах, хотим отметить, что единственная возможность для изменения человеческой ДНК – это использование в составе вакцин фермента интегразы, способного объединить две молекулы ДНК в одну. Но производители не используют этот фермент при изготовлении вакцин. Зато этим ферментом обладает существо, которое живет с нами рядом уже миллионы лет.
Что вирус может сделать с нашей ДНК?
Итак, вирус действительно способен изменить ДНК человеческой клетки. Но далеко не каждый! Такой способностью обладают только ретровирусы.
Это семейство вирусов обладает особым ферментом – «интегразой». Этот фермент буквально приклеивает вирусный геном к ДНК человека, подчиняя себе клетку и заставляя ее создавать новые ретровирусы.
В большинстве случаев зараженная клетка с испорченным ДНК погибает. Однако в редких случаях ретровирус заражает сперматозоид или яйцеклетку. И если происходит оплодотворение с участием зараженной клетки, то абсолютно все клетки эмбриона будут содержать вирусную ДНК. Фактически, этот вирус способен создавать мутантов.
К счастью, это происходит крайне редко. Последний раз ретровирус изменил геном человека более 100 тысяч лет назад. Однако за время эволюции это происходило много раз, поэтому ДНК человека на целых 8% состоит из кусочков ДНК древних ретровирусов, которые заражали половые клетки наших предков.
Ученые утверждают, что ретровирусы являются мощным двигателем эволюции. Например, именно благодаря встрече с ретровирусом у предка всех млекопитающих, жившего 160 миллионов лет назад, появился такой важный орган как плацента.
Интересный факт!
Ретровирус может быть как относительно безопасным, так и смертельным. Самым опасным ретровирусом для человека является ВИЧ.
Почему люди относятся с подозрением к новым вакцинам?
Вакцины, созданные методами генной инженерии, совсем недавно вошли в нашу жизнь, но пока не известен ни один случай генных мутаций, связанных с вакцинацией. Однако люди склонны опасаться нового и неизвестного и поэтому часто верят в нелепые теории заговора о массовом чипировании или планах мирового правительства по снижению населения Земли. Как правило, лица, распространяющие подобные теории, имеют весьма приблизительное представление о том, как работают современные вакцины. Покажите им эту статью – возможно, этим Вы кому-то спасете жизнь.