Генная инженерия что получают
Что такое генная инженерия и зачем вмешиваться в природу организмов
Содержание:
Генная инженерия — это современное направление биотехнологии, объединяющее знания, приемы и методики из целого блока смежных наук — генетики, биологии, химии, вирусологии и так далее — чтобы получить новые наследственные свойства организмов.
Перестройка генотипов происходит путем внесения изменений в ДНК (макромолекулу, обеспечивающую хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов) и РНК (одну из трех основных макромолекул, содержащихся в клетках всех живых организмов).
Если внести в растение, микроорганизм, организм животного или даже человека новые гены, можно наделить его новой желательной характеристикой, которой до этого он никогда не обладал. С этой целью сегодня генная инженерия используется во многих сферах. Например, на ее основе сформировалась отдельная отрасль фармацевтической промышленности, представляющая собой одну из современных ветвей биотехнологии.
История развития
Истоки
Основы классической генетики были заложены в середине XIX века благодаря экспериментам чешского-австрийского биолога Грегора Менделя. Открытые им на примере растений принципы передачи наследственных признаков от родительских организмов к их потомкам в 1865 году, к сожалению, не получили должного внимания у современников, и только в 1900 году Хуго де Фриз и другие европейские ученые независимо друг от друга «переоткрыли» законы наследственности.
Параллельно с этим шел процесс формирования знаний о ДНК. Так, в 1869 году швейцарский биолог Фридрих Мишер открыл факт существования макромолекулы, а в 1910 году американский биолог Томас Хант Морган обнаружил на основе характера наследования мутаций у дрозофил, что гены расположены линейно на хромосомах и образуют группы сцепления. В 1953 году было сделано важнейшее открытие — американец Джон Уотсон и британец Фрэнсис Крик установили молекулярную структуру ДНК.
На подъеме
К концу 1960-х годов генетика активно развивалась, а ее важными объектами стали вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов, а в 1970-х годах был открыт ряд ферментов, катализирующих реакции превращения ДНК.
Генная инженерия как отдельное направление исследовательской работы зародилась в США в 1972 году, когда в Стэнфордском университете ученые Пол Берг, Стэнли Норман Коэн, Герберт Бойер и их научная группа внедрили новый ген в бактерию кишечной палочки (E. coli), то есть создали первую рекомбинантную ДНК.
Техника ПЦР была впервые разработана в 1980-х годах американским биохимиком Кэри Маллисом. Будущий лауреат Нобелевской премии по химии (1993 года), обнаружил в специфический фермент — ДНК-полимеразу, который участвует в репликации ДНК. Этот фермент буквально считывает отрезки цепи нуклеотидов молекулы и использует их в качестве шаблона для последующего копирования генетической информации.
Новая эра
В 1996 году методом пересадки ядра соматической клетки в цитоплазму яйцеклетки на свет появилось первое клонированное млекопитающее — овца Долли. Это событие стало революционным в истории развития генной инженерии, потому что впервые стало возможным серьезно говорить о создании клонов и выращивании живых организмов на основе молекул.
Технологии генной инженерии
Генная инженерия за короткий срок оказала огромное влияние на развитие различных молекулярно-генетических методов и позволила существенно продвинуться на пути познания генетического аппарата.
Так, появилась технология CRISPR — инструмент редактирования генома. В 2014 году MIT Technology Review назвал его «самым большим биотехнологическим открытием века». Он основан на защитной системе бактерий, которые производят специальные ферменты, позволяющие им защищаться от вирусов.
«Каждый раз, когда бактерия убивает вирус, она разрезает остатки его генома, будь то ДНК или РНК, и сохраняет их внутри последовательности CRISPR, как в архив. Как только вирус атакует снова, бактерия использует информацию из «архива» и быстро производит защитные белки Cas9, в которых заключены фрагменты генома вируса. Если вдруг эти фрагменты совпадают с генетическим материалом нынешнего атакующего вируса, Cas9 как ножницами разрезает захватчика, и бактерия снова в безопасности», — поясняет Алевтина Федина, медицинский директор Checkme.
Уникальное открытие состоялось в 2011 году, когда биологи Дженнифер Дудна и Эммануэль Шарпантье обнаружили, что белок Cas9 можно обмануть. Если дать ему искусственную РНК, синтезированную в лаборатории, то он, найдя в «архиве» соответствие, нападет на нее. Таким образом, с помощью этого белка можно резать геном в нужном месте — и не просто резать, а еще и заменять другими генами.
Теоретически, технология CRISPR может позволить редактировать любую генетическую мутацию и излечивать заболевание, которое она вызывает. Но практические разработки CRISPR в качестве терапии еще только в начальной стадии, и многое еще непонятно.
Есть и другие методы генной инженерии, например, ZFN и TALEN.
Где и как применяется генная инженерия
Медицина
Уже сейчас активно применяется инсулин человека (хумулин), полученный посредством рекомбинантных ДНК. Клонированные гены человеческого инсулина были введены в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали. С 1982 года компании США, Японии, Великобритании и других стран производят генно-инженерный инсулин.
Кроме того, несколько сотен новых диагностических препаратов уже введены в медицинскую практику. Среди лекарств, находящихся в стадии клинического изучения, препараты, потенциально лечащие артрозы, сердечно-сосудистые заболевания, онкологию и СПИД. Среди нескольких сотен генно-инженерных компаний 60% заняты именно разработкой и производством лекарственных и диагностических средств.
«В медицине среди достижений генной инженерии сегодня можно выделить терапию рака, а также другие фармакологические новинки — исследования стволовых клеток, новые антибиотики, прицельно бьющие по бактериям, лечение сахарного диабета. Правда, пока все это на стадии исследований, но результаты многообещающие», — говорит Алевтина Федина.
Сельское хозяйство
В сельском хозяйстве одна из важнейших задач генной инженерии — получение растений и животных, устойчивых к вирусам. В настоящее время уже есть виды, способные противостоять воздействию более десятка различных вирусных инфекций.
Еще одна задача связана с защитой растений от насекомых-вредителей. Путем генетической модификации растений можно уменьшить интенсивность обработки полей пестицидами. Например, трансгенные растения картофеля и томатов стали устойчивы к колорадскому жуку, растения хлопчатника — к разным насекомым, в том числе и к хлопковой совке.
Использование генной инженерии позволило сократить применение инсектицидов (препаратов для уничтожения насекомых) на 40–60%.
Благодаря генной инженерии зерновые культуры стали более устойчивы к климатическим условиям, кроме того появилась возможность увеличить количество витаминов и полезных веществ в продукте. Например, можно обогатить рис витамином «А» и выращивать его в тех регионах, где люди имеют массовую нехватку этого элемента.
С помощью генной инженерии пытаются решить и экологические проблемы. Так, уже созданы особые сорта растений с функцией очистки почвы. Они поглощают цинк, никель, кобальт и иные опасные вещества из загрязненных промышленными отходами почв.
Скотоводство
В Кемеровской области работа генетиков позволила получить устойчивое к вирусу лейкоза племенное поголовье высокопродуктивных животных. Для проведения эксперимента кузбасские ученые отобрали здоровых коров черно-пестрой породы массой до 500 кг. Животным трансплантировали модифицированные эмбрионы, устойчивые к вирусу лейкоза. В середине сентября 2020 года родилось 19 телят с измененными генами.
«В месячном возрасте была проведена оценка, которая показала, что телята отличаются от своих сверстников только устойчивостью к вирусу. Пять особей отобрали для дальнейшей селекционной работы. Это позволит закрепить наследственные признаки устойчивости к вирусу лейкоза у последующих поколений», — пояснила руководитель проекта, доктор биологических наук, профессор кафедры зоотехнии Кузбасской ГСХА Татьяна Зубова.
По словам Зубовой, лейкоз крупного рогатого скота — вирусная хронически неизлечимая болезнь, при которой возникают поражение кроветворной системы и новообразования. Данное заболевание наносит значительный ущерб генофонду пород и мясной промышленности в целом, потому что мясо зараженных животных запрещено употреблять в пищу. Единственным доступным методом борьбы с лейкозом ранее было только уничтожение зараженного скота.
Этот успех позволяет говорить о том, что в дальнейшем будет возможно редактировать гены крупного рогатого скота и от других болезней.
С прицелом на человека
В 2009 году группа ученых под руководством молодого исследователя Джея Нейтца из Вашингтонского университета сумели с помощью генной терапии вернуть обезьянам способность различать оттенки зеленого и красного, которой они были лишены от рождения.
В область сетчатки глаза двух подопытных обезьян был введен безвредный вирус, несущий недостающий ген фоточувствительного рецептора. Вскоре после процедуры обе обезьяны начали различать оттенки красного и зеленого на сером фоне. Два года наблюдения не выявили у них каких-либо нарушений, поэтому ученые не исключают, что данную методику уже вскоре можно будет применять у людей, страдающих дальтонизмом.
Ученые шагнули еще дальше и уже пробуют выращивать в теле животных органы для трансплантации людям. Для минимизации риска отторжения тканей животным вводят специальные гены. Этими опытами занимается научная лаборатория Рослинского института в Великобритании, которая представила миру овцу Долли.
В 2019 году британские ученые вывели кур, яйца которых содержат два вида человеческих белков, способных противодействовать артриту и некоторым видам онкологических заболеваний. В яйцах содержится человеческий белок под названием IFNalpha2a, обладающий мощными противовирусными и противораковыми свойствами, а также человеческий и свиной вариант белка под названием макрофаг-CSF, который планируют использовать для создания препарата, стимулирующего самостоятельное заживление поврежденных тканей.
Изменение ДНК человека
Первые клинические испытания методов генной терапии были предприняты 22 мая 1989 года с целью генетического маркирования опухоль-инфильтрующих лимфоцитов в случае прогрессирующей меланомы.
14 сентября 1990 года в Бетесде (США) четырехлетней девочке, страдающей наследственным иммунодефицитом, обусловленным мутацией в гене аденозиндезаминазы (АDA), были пересажены ее собственные лимфоциты.
Работающая копия гена ADA была введена в клетки крови с помощью модифицированного вируса, в результате чего клетки получили возможность самостоятельно производить необходимый белок. Через шесть месяцев количество белых клеток в организме девочки поднялось до нормального уровня.
После этого область генной терапии получила толчок к дальнейшему развитию. С 1990-х годов сотни лабораторий ведут исследования по использованию генной терапии для лечения различных заболеваний. Уже сегодня с помощью генной терапии можно лечить диабет, анемию и некоторые виды онкологии.
Генная терапия
Генная терапия — введение, удаление или изменение генетического материала, в частности ДНК или РНК, в клетке пациента для лечения определенного заболевания.
Существует три основных стратегии использования генной терапии:
Наиболее часто применяемый метод включает вставку «терапевтического» гена для замены «ненормального» или «вызывающего болезнь».
В 2015 году впервые была проведена процедура изменения ДНК человека с целью продления молодости клеток, когда американке Элизабет Пэрриш 44 лет ввели в организм препарат, влияющий на ДНК, а в 2018 году китайский ученый Хэ Цзянькуй заявил, что с его помощью у двух детей-близнецов якобы изменены гены для выработки у них иммунитета к вирусу ВИЧ, носителем которого являлся их отец.
Все это, с одной стороны, выглядит грандиозно и обнадеживает, но с другой, — вызывает опасения, ведь генетические манипуляции, теоретически, возможно использовать не только в благих и мирных целях.
После эксперимента с ДНК близнецов в Китае, ЮНЕСКО выступила с инициативой о запрете изменения генов у новорожденных до того момента, пока достоверно не будет доказана безопасность таких манипуляций.
Этическая сторона вопроса
В 1997 году ЮНЕСКО выпустила Всеобщую декларацию о геноме человека и его правах, рекомендовав мораторий на генетическое вмешательство в зародышевую линию человека, а в декабре 2015 года на международном саммите по геномному редактированию человека изменение гаметоцитов и эмбрионов для генерации наследственных изменений у людей было объявлено безответственным.
Российское сообщество генетиков в большинстве своем считает, что такие эксперименты на данный момент преждевременны и требуют более глубокого исследования и обсуждений.
«Вопрос клонирования уже давно стоит на горизонте. Этично ли выращивать клонов, чтобы потом забирать их органы для трансплантации человеку… Большой вопрос. Само собой, это абсолютно нормально, что нет единой точки зрения, ведь смысл подобных дискуссий как раз в том, чтобы найти правильные формулировки и отрегулировать потенциально спасительное, но при этом очень опасное знание», — говорит Алевтина Федина.
Страх неизвестности
Вариантов развития событий в области генной инженерии существует множество, и далеко не все они изучены и, в принципе, известны. Поэтому они должны быть последовательно зафиксированы и регламентированы.
Естественно, больше всего опасений вызывают плохие сценарии развития событий. Как правило, все начинается с помощи людям и изобретения новых лекарств. Но потом человек может прийти к желанию сделать своего ребенка светловолосым и зеленоглазым или создать армию универсальных солдат, не боящихся боли и не ведающих страха.
Олег Долгицкий, социальный философ, отмечает, что современное общество настолько неоднородно в культурном и экономическом плане, что любые методы, способные существенно изменить геном, могут создать условия не только для классового, но и видового расслоения, где представители «первого мира» смогут существенно продлевать свою жизнь и не бояться никаких болезней, в отличие от менее богатых людей. Это является серьезнейшей почвой для конфликтов и столкновений.
Эксперты убеждены, что генная инженерия — это будущее медицины. Возможность избавить младенца от пожизненного гнета заболевания, излечить людей от рака, найти лекарство против ВИЧ — за всем этим будет стоять генная инженерия. При этом желание человека изменить, например, цвет глаз или предотвратить наследственное заболевание, несмотря на все риски, будет только расти. И похоже, что остановить этот процесс уже не представляется возможным.
12 методов в картинках: генная инженерия. Часть I, историческая
12 методов в картинках: генная инженерия. Часть I, историческая
Авторы
Редакторы
Полвека назад человек вплотную приблизился к возможности примерить на себя роль творца, творца самого настоящего, способного целенаправленно наделять создаваемые им организмы нужными чертами. Научившись напрямую манипулировать генами, из селекционера он превратился в инженера. Что же подвело его к этой черте и как изменился мир после? Предлагаем заглянуть в историю генной инженерии: вспомнить важнейшие открытия, сформировавшие ее теоретическую основу и методический арсенал, поразмышлять над этическими вопросами и оценить вес генно-инженерных разработок в денежном эквиваленте.
12 биологических методов в картинках
Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Генетическая, или генная, инженерия — это не отдельная наука, а огромная и постоянно развивающаяся научно-технологическая платформа, вобравшая в себя самое ценное из генетики, биохимии и химической инженерии, молекулярной и клеточной биологии, микробиологии и вирусологии. Благодаря этой платформе у землян появилась возможность обсуждать такие понятия, как генетически модифицированный организм (ГМО) и генная терапия. Генная инженерия в широком смысле — это третье поколение инструментов для изменения наследственной информации. В отличие от первых двух — селекции, применяемой тысячелетиями, и индуцированного мутагенеза, создавшего с начала 20 века более двух тысяч разновидностей растений [1], — новый инструмент работает прецизионно и быстро. А потому порождает непредставимые ранее научные соблазны и коллективные фобии. Кто-то видит в генной инженерии спасение человечества, кто-то — козни дьявола, но все сходятся в одном: она изменила мир. Инструментарий и технологии генной инженерии мы разберем во второй части статьи, а пока пройдем путем, по которому шли ученые к созданию этой отрасли и ее современным достижениям (рис. 1).
Рисунок 1. Краткая история генной инженерии. 1865 г. — Грегор Мендель, скрещивая горох, описал законы наследственности. 1869 г. — Иоганн Фридрих Мишер выделил из лейкоцитов вещество нуклеин, содержащее ДНК. 1888–1909 гг. — Начала формироваться генетическая терминология: появились понятия «ген», «генотип», «фенотип», «хромосома», «мутация». 1892 г. — Д.И. Ивановский впервые описал передачу болезнетворного начала посредством агентов, проходящих через бактериальные фильтры и позже названных вирусами. 1901 г. — Альбрехт Коссель обнаружил в составе небелкового компонента нуклеина — нуклеиновых кислот — азотистые основания: аденин, гуанин, цитозин, тимин и урацил. 1903 г. — Уолтер Саттон и Теодор Бовери предположили, что физическим субстратом менделевского наследования служат хромосомы. 1910 г. и позже — Морган, Бриджес, Стёртевант и Мёллер показали, как гены расположены на хромосомах, и развили хромосомную теорию наследственности Саттона и Бовери. 1915–1917 гг. — Фредерик Туорт и Феликс д’Эррель обнаружили вирусы бактерий — бактериофаги. 1928 г. — Фредерик Гриффит впервые наблюдал бактериальную трансформацию — горизонтальную передачу наследственной информации между бактериями. 1941 г. — Джордж Бидл и Эдвард Тейтем сформулировали гипотезу «один ген — один фермент». 1944 г. — Эвери, Маклауд и Маккарти показали, что трансформирующий фактор Гриффита представляет собой ДНК. 1952 г. — Альфред Херши и Марта Чейз подтвердили, что субстрат наследственности — ДНК. 1940–1950-е гг. — Описаны конъюгация и трансдукция — процессы переноса генетического материала между бактериальными клетками с помощью плазмид и фагов. 1948 г. — Барбара Макклинток обнаружила в ДНК кукурузы транспозоны. 1953 г. — С помощью рентгеновской кристаллографии установлена структура ДНК. 1955 г. — Северо Очоа и Марианна Грюнберг-Манаго выделили полинуклеотидфосфорилазу и синтезировали с ее помощью цепь РНК. 1956 г. — Артур Корнберг выделил ДНК-полимеразу I, первый из ферментов, способных копировать ДНК, и синтезировал с ее помощью цепь ДНК. 1960 г. — Франсуа Жакоб и Жак Моно описали функциональную единицу прокариотического генома — оперон, — показав, что экспрессия генов регулируется на уровне транскрипции. 1960-е гг. — Изучены структура и функции мРНК и тРНК, расшифрован генетический код. 1967 г. — Бернард Вайсс и Чарльз Ричардсон впервые показали Т4-лигазу в действии. 1969 г. — Говард Темин зафиксировал у ретровирусов обратную транскрипцию — синтез ДНК по матрице РНК. 1969 г. — Изобретена ДНК-ДНК- и РНК-ДНК-гибридизация. 1970 г. — Гамильтон Смит выделил первую эндонуклеазу рестрикции II типа. 1970 г. — Мортон Мандель и Акико Хига нашли способ делать клетки бактерий компетентными — способными лучше принимать ДНК из внешней среды. 1972 г. — Кес Ай и Пит Борст применили электрофорез ДНК в агарозном геле с этидиум бромидом в качестве визуализирующего вещества. 1970-е гг. — Разработаны способы введения генов в растительные клетки с помощью Ti-плазмид и микроинъекций. 1972 г. — Пол Берг получил первую рекомбинантную ДНК. 1972 г. — Ананда Чакрабарти получил генетически модифицированные псевдомонады, в которых уживались несколько разных плазмид биодеградации. 1973 г. — Герберт Бойер и Стэнли Норман Коэн получили первый организм, содержащий рекомбинантную ДНК. 1974 г. — Герберт Бойер и Стэнли Норман Коэн получили первую бактерию, несущую эукариотический ген — ген рибосомной РНК лягушки. 1974 г. — Рудольф Йениш создал первое трансгенное млекопитающее. 1975 г. — Созвана Асиломарская конференция, регламентировавшая работу с рекомбинантными ДНК. 1977 г. — Созданы достаточно производительные методы секвенирования ДНК. 1977 г. — Филлип Шарп и Ричард Робертс обнаружили в ДНК эукариот интроны. 1978–1979 гг. — Genentech произвела первые рекомбинантные белки — соматотропин и инсулин. 1980-е гг. — Разработаны способы введения генов в клетки с помощью электропорации и обстрела из генной пушки. 1982 г. — Томас Чех и Сидни Альтман открыли рибозимы. 1983 г. — Кэри Мюллис разработал метод ПЦР. 1983 г. — Появилось первое трансгенное растение. 1990 г. — Обнаружена РНК-интерференция, механизм которой в 1998 описали Крейг Мелло и Эндрю Файер. 1995–1996 гг. — Секвенированы первые про- и эукариотические геномы. 1996 г. — Сконструированы сайт-специфические нуклеазы «цинковые пальцы» (ZFN). 2000 г. — Создан «золотой рис» — первое инженерное растение с повышенной пищевой ценностью. 2003 г. — Почти полностью прочитан геном человека. 2010 г. — Группа Крейга Вентера и Гамильтона Смита создала Синтию — первый организм с полностью синтетической хромосомой. 2011 г. — Сконструированы сайт-специфические нуклеазы TALEN. 2011 г. — Зарегистрирован первый российский генно-терапевтический препарат, «Неоваскулген». 2012 г. — В Европе одобрено первое генно-терапевтическое лекарство, Glybera. 2012 г. — Разработана технология геномного редактирования CRISPR-Cas9. 2014 г. — Получена бактерия с расширенным генетическим кодом. 2014–2017 гг. — Первые попытки клинического редактирования ДНК человека инженерными нуклеазами. 2017 г. — В США одобрено первое генно-терапевтическое лекарство, Kymriah.
История генной инженерии
Точка невозврата
Генная инженерия рождалась в 1971–1973 годах сразу в нескольких американских лабораториях. Но, пожалуй, ее инкубатором можно назвать Стэнфорд — именно там и тогда в нужной пропорции знания соединились с реактивами [2]. О роли «рекомбинантного университета» в становлении молекулярной биотехнологии и ее коммерциализации написана целая книга [3].
В 1972-м группа стэнфордского биохимика Пола Берга (рис. 2) впервые провела сплайсинг генов — сшила фрагменты ДНК разного происхождения, получив так называемую рекомбинантную ДНК: в ее состав вошли участки геномов онкогенного вируса SV40 и бактериофага λ, несущего галактозный оперон кишечной палочки [4], [5]. Создание такой химеры сразу же вызвало опасения некоторых биологов относительно безопасности ее введения в клетки живых организмов. Заразился этими опасениями и сам Берг. Группа отложила эксперименты in vivo, добровольно отказавшись от славы создателей первого генетически модифицированного организма. А главное, с тех самых пор развитие генной инженерии постоянно сопровождали и ограничивали всевозможные этические дилеммы (см. врезку «Рекомбинантные ДНК и биоэтика»).
Рисунок 2. Пол Берг со своей невестой Милли. Кстати, будущий нобелевский лауреат родился в семье, перебравшейся в США из маленькой деревушки под Минском.
В 1973-м журнал PNAS рассказал о первом организме, полученном с помощью рекомбинантной ДНК. Escherichia coli несла рекомбинантную плазмиду, «сшитую» из фрагментов двух разных плазмид антибиотикорезистентности — векторной pSC101 (plasmid, Stanley Cohen, 101) и R6-5 — и функционально ничем не уступала молекулам природным [6]. В роли демиургов выступили сотрудники Калифорнийского и Стэнфордского университетов: Герберт Бойер (рис. 3), Энни Чен, Роберт Хелинг и Стэнли Коэн (не тот, что нобелевский лауреат, биохимик, а бактериальный генетик, Стэнли Норман Коэн). Этот коллектив осознал и постепенно показал, что в принципе любой ген из любого организма можно с помощью особых ферментов легко внедрить в векторную плазмиду и экспрессировать в совершенно ином генетическом окружении. Как развивалась эта идея и ставились эксперименты по молекулярному клонированию, можно узнать из первых уст — от самого Стэнли Коэна [7].
Рисунок 3. Герберт Бойер и Стэнли Коэн — создатели первого трансгенного организма и обладатели первого генно-инженерного патента.
Что было до?
Конечно, генная инженерия — не плод чьего-то озарения. Для ее возникновения в США сложились удачные научные и политические предпосылки: синергетический эффект дали рузвельтовские программы госфинансирования фундаментальных исследований, возможности новых приборов, накопленный багаж знаний о наследственности. Этот багаж уже давно начали собирать в разных уголках Старого Света: в середине 19 века по Европе бродили сразу два призрака — коммунизма и генной инженерии. Тогда у биологов уже был микроскоп и недооцененные «гороховые» законы наследственности Менделя. В 1869 году к ним добавилась выделенная швейцарцем Иоганном Фридрихом Мишером ДНК. Поначалу странно-кислое вещество из ядер нейтрофилов гноя назвали нуклеином и посчитали, что оно служит хранилищем фосфора — уж больно много его там было. Немец Альбрехт Коссель, будущий нобелевский лауреат, к 1901 году установил, что в состав очищенного небелкового компонента нуклеина — нуклеиновых кислот — входят пять азотистых оснований: аденин, гуанин, цитозин, тимин и урацил. Заподозрить такие простые соединения, как нуклеиновые кислоты, в передаче наследственной информации тогда было невозможно — более подходящими кандидатами казались белки.
В 1886-м голландец Гуго де Фриз ввел термин панген для обозначения гипотетической частицы наследственности (до гена его позже урезал Вильгельм Иогансен), а в 1905-м англичанин Уильям Бейтсон назвал изучение наследственности генетикой. В 1888-м сегменты, на которые распадается хроматин во время клеточного деления, Генрих Вильгельм Вальдейер назвал хромосомами. На рубеже веков огородные эксперименты привели де Фриза и независимо от него австрийца фон Чермака, немца Корренса и американца Шпильмана к «переоткрытию» менделевских законов. В 1903-м де Фриз наблюдал у энотеры первую «мутацию», а Саттон и Бовери предположили, что физическим субстратом менделевского наследования служат хромосомы.
В 1892 году русский микробиолог и физиолог растений Дмитрий Иосифович Ивановский, работая с растениями табака, зараженными мозаичной болезнью, обнаружил совершенно новые инфекционные агенты, проходящие через мельчайшие бактериальные фильтры. Наблюдавший то же самое, но чуть позже, Мартин Бейеринк назвал эти биологические объекты вирусами. Нечто похожее произошло и с открытием вирусов бактерий — бактериофагов. Их обнаружили независимо друг от друга Фредерик Туорт (1915) и Феликс д’Эррель (1917), причем последний дал им имя и использовал их для лечения бактериальных инфекций у людей. Так родилась фаговая терапия [8]. Увидеть всю эту вирусную братию удалось гораздо позже, после появления электронного микроскопа в начале 1930-х [9]. А еще позже научились с помощью фагов доставлять гены в бактериальные клетки и использовать их «запчасти» — ферменты и регуляторные элементы — в работе с нуклеиновыми кислотами. Вирусы животных стали основными векторами, доставляющими нужные гены в клетки человека и других млекопитающих.
Существенно продвинуться в понимании природы наследственности помогли мушки дрозофилы, а затем и бактерии. В 1910-м профессор Колумбийского университета Томас Морган (рис. 4) показал, что гены расположены линейно на хромосомах и образуют группы сцепления. Этим он заслужил Нобелевскую премию [10]. Морган и его сотрудники — Бриджес, Стёртевант и Мёллер — составили первые карты хромосом, экспериментально подтвердили и развили хромосомную теорию наследственности Саттона и Бовери [11].
Рисунок 4. Томас Хант Морган и его жена Лилиан. Благодаря блестящей работе супругов в лабораторную моду надолго вошла дрозофила. Самые интересные ее мутанты разлетались из «мушиной комнаты» Моргана в Колумбийском университете как горячие пирожки.
В 1928-м британский бактериолог Фредерик Гриффит в надежде получить вакцину от пневмококка впервые наблюдал бактериальную трансформацию: посредством какого-то трансформирующего фактора убитый вирулентный штамм бактерий передал свою вирулентность живому неопасному штамму. То, что трансформирующим фактором была именно ДНК, в 1944 году остроумно показали американцы Эвери, Маклауд и Маккарти (рис. 5). «Виновника» вычислили по оружию, которое его убивает: трансформирующий эффект нивелировался исключительно ДНКазами. В 1952 году Альфред Херши и Марта Чейз подтвердили роль ДНК в передаче наследственных признаков уже с помощью радиоактивно меченных бактериофагов. Это серьезно пошатнуло уверенность в белковой природе наследственности (до той поры делали ставку на белковый компонент хромосом), но всё еще не хватало объяснения, как именно работает ДНК.
Рисунок 5. Они показали, что наследственная информация записана в ДНК: Колин Маклауд, Освальд Эвери, Маклин Маккарти.
В 1941-м благодаря рентгеновскому мутагенезу плесени Neurospora crassa, проведенному Джорджем Бидлом и Эдвардом Тейтемом, появилась гипотеза «один ген — один фермент»: каждый ген отвечает за синтез какого-то одного фермента, который катализирует какую-то метаболическую реакцию.
В 1940-х и начале 1950-х Эдвард Тейтем, Нортон Зиндер, Джошуа и Эстер Ледерберги (рис. 6) описали основные процессы переноса генетического материала между бактериальными клетками с помощью плазмид и фагов (в частности, конъюгацию и трансдукцию). Эти мобильные генетические элементы [12] позже стали неотъемлемыми компонентами арсенала генного инженера.
Рисунок 6. Джошуа и Эстер Ледерберги. Несмотря на сексистскую атмосферу тех лет, Эстер Мириам Ледерберг заслужила искреннее восхищение коллег: в числе ее заслуг — открытие и изучение фага λ, F-плазмиды и трансдукции, введение знакомого теперь каждому микробиологу и многим генным инженерам метода реплик, организация в Стэнфорде специализированного плазмидного центра.
Рисунок 7. «Великая кукурузница» — нобелевский лауреат Барбара Макклинток — и ее коллега, Гарриет Крейтон. Барбара и Гарриет описали рекомбинацию в ходе мейотического кроссинговера хромосом кукурузы. Своему научному объекту Макклинток почти не изменяла. А если и изменяла, то с пользой: прибыв в 1944 году в Стэнфорд по приглашению Джорджа Бидла, Макклинток за пару месяцев полностью цитогенетически охарактеризовала грибок Neurospora crassa.
Еще один класс мобильных ДНК — транспозоны (изначально — «контролирующие элементы») — в 1948 году обнаружила Барбара Макклинток, известная пионерскими работами по кроссинговеру хромосом (рис. 7) [13], [14]. Она предположила, что эти мобильные элементы участвуют в регуляции активности генов. То, что гены — не статичные, а управляемые инструкции, было слишком уж странной мыслью для того времени.
В том же году сотрудник Кембриджа Александер Робертус Тодд, изучавший структуру нуклеотидов, впервые химически синтезировал один из них — аденозинтрифосфат, или АТФ (сахар рибоза + азотистое основание аденин + фосфатные группы).
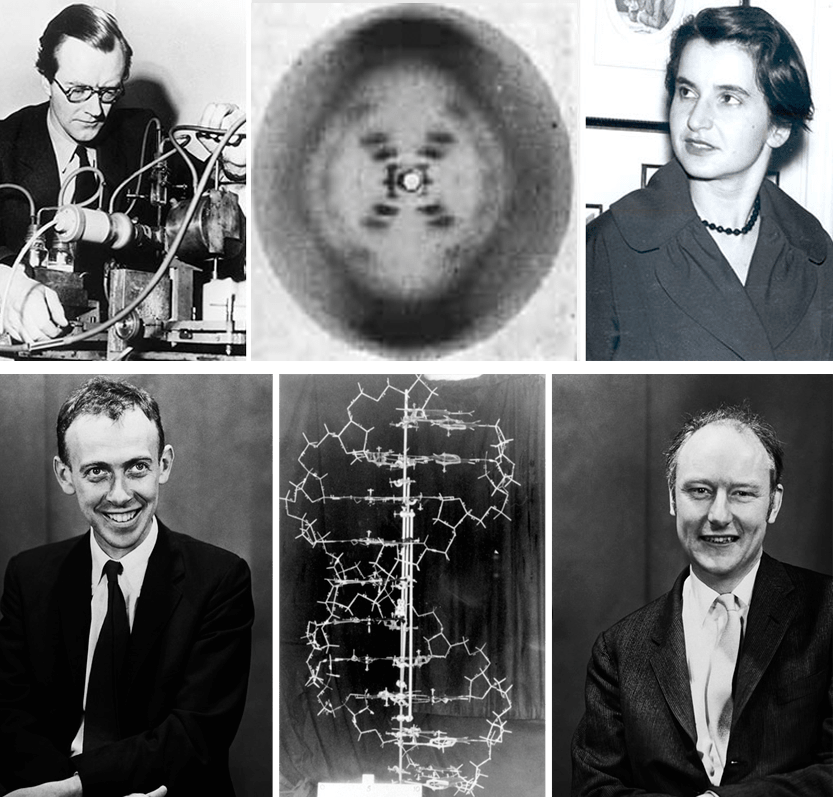
В 1953 году произошло эпохальное событие — установление молекулярной структуры ДНК. Верную модель обычной, B-формы, ДНК построили сотрудники Кембриджского университета Джеймс Уотсон и Фрэнсис Крик, а базисом для ее создания послужили работы рентгеноструктурщиков из Королевского колледжа Лондона — Мориса Уилкинса и Розалинд Франклин с ее аспирантом, Реймондом Гослингом (рис. 8). Дифракционное изображение кристаллизованной ДНК указывало на ее двуспиральный характер, и Франклин даже удалось рассчитать некоторые параметры этой спирали. Уотсон и Крик, заполучив материалы Франклин и держа в уме пропорции азотистых оснований, вычисленные в 1950-м Эрвином Чаргаффом, предположили, как закодирована и как передается наследственная информация. Полуконсервативный механизм репликации ДНК в знаменитом изотопном эксперименте доказали Метью Мезельсон и Франклин Сталь в 1958 году.
Рисунок 8. Им покорилась двойная спираль. Вверху — Морис Уилкинс и Розалинд Франклин с вошедшим в историю Фото 51 — самой удачной рентгенограммой ДНК. Внизу — Джеймс Уотсон и Фрэнсис Крик со своей моделью ДНК. Им всё-таки удалось опередить другого талантливого ученого — Лайнуса Полинга, известного своей любовью к аскорбинке и расшифровке структуры молекул.
В 1955-м Северо Очоа де Альборнос с аспиранткой, Марианной Грюнберг-Манаго (уроженкой Петрограда и будущим президентом Международного биохимического союза), выделили бактериальную полинуклеотидфосфорилазу и с ее помощью синтезировали в пробирке РНК. Позже оказалось, что синтез для этого фермента скорее хобби, основная же его работа — деградация РНК. В 1956-м Артур Корнберг (рис. 9) со своей женой Сильви выделил один из ферментов синтеза и коррекции ДНК — ДНК-полимеразу I — и получил с его помощью цепочку ДНК [15]. Как и в случае Очоа, фермент Корнберга не был главным строителем полинуклеотидных цепей, однако стал одним из основных инструментов генной инженерии.
Рисунок 9. Артур Корнберг с первой женой, Сильви, и сыновьями (Стокгольм, 1959 г.). Старший сын, Роджер (слева), займется изучением эукариотической транскрипции и снова приедет в Стокгольм в 2006-м — уже за своей «нобелевкой»; средний, Томас (справа), выделит ДНК-полимеразы II и III; младший, Кеннет, будет проектировать биотехнологические здания и лаборатории. Сильви как биохимик, внесший весомый вклад в открытие и изучение ДНК-полимеразы I, не получит никакого признания и скончается в 1986-м. Артуру не удастся пережить только свою третью жену.
В первой половине 60-х Метью Мезельсон, Франсуа Жакоб и Сидни Бреннер подтвердили существование матричной РНК (мРНК), а Роберт Холли описал структуру и даже установил нуклеотидную последовательность транспортной РНК (тРНК) — молекулярного адаптера, объяснившего, как инструкции, заложенные в ДНК и переписанные в мРНК, определяют построение аминокислотных цепочек. Тогда же стартовала «кодовая гонка»: нужно было понять, как именно «буквы» мРНК переводятся на белковый язык. Расшифровкой генетического алфавита активно занимался Очоа, но наработать достаточно для Нобелевской премии материала удалось Хару Коране и Маршаллу Ниренбергу. Благодаря им мы знаем, что одну аминокислоту кодируют три нуклеотида, и даже какую именно аминокислоту какие именно триплеты кодируют.
Примерно тогда же, наконец, всплыли вопросы регуляции работы генов — те, что чуть раньше научное сообщество не хотело слышать из уст Барбары Макклинток. Жакоб вместе с Жаком Моно описали лактозный оперон и показали, что синтез ферментов контролируется внешними условиями посредством регуляторных белков, которые подавляют или активируют транскрипцию.
Ферментативную «иголку», способную сшивать фрагменты нуклеиновых кислот, описали в 1967 году гарвардские биохимики Бернард Вайсс и Чарльз Ричардсон. Одноцепочечные разрывы (ники) в двухцепочечной ДНК они генерировали с помощью панкреатической ДНКазы, а для восстановления фосфодиэфирных связей использовали полинуклеотидлигазу, выделенную из зараженной фагом Т4 E. coli. Так появился один из основных инструментов генных инженеров — Т4-лигаза. Без лигаз не обходится молекулярное клонирование, а также один из вариантов секвенирования нового поколения [16].
В 1969-м вирусолог Говард Темин вплотную приступил к доказательству «обратного тока» информации — от РНК к ДНК (стандартный, «прямой» путь реализации наследственной информации — от ДНК через РНК в белок). На это оказались способны онкогенные РНК-содержащие вирусы типа вируса саркомы Рауса, то есть ретровирусы. Прежде чем встроиться в хромосомы пораженной клетки, эти агенты с помощью собственного фермента, обратной транскриптазы [17], синтезируют ДНК-копию своего генома. Этот же фермент независимо обнаружил и Дэвид Балтимор, работая с вирусом мышиной лейкемии.
В том же году Мэри-Лу Пардью, известный борец против дискриминации женщин в Массачусетском технологическом институте, и Джозеф Голл разработали методы ДНК-ДНК- и РНК-ДНК-гибридизации. Это были варианты технологии «гибридизация in situ», когда радиоактивно меченный фрагмент ДНК или РНК используется в качестве зонда для обнаружения искомой (комплементарной зонду) нуклеотидной последовательности в тканях или клетках. Разные варианты гибридизации эксплуатируются генными инженерами и сейчас, в эпоху рутинного секвенирования.
После «взламывания» генетического кода и получения первых представлений о контроле работы генов появление генной инженерии стало делом техники: не хватало лишь некоторых инструментов.
Полезные ферментативные «ножницы» — эндонуклеазы рестрикции (рестриктазы) II типа — в 1970 году выделили из бактерии Haemophilus influenzae Гамильтон Смит (рис. 10) и Том Келли. До этого Вернер Арбер и Мезельсон описали работу почти бесполезных на практике, но важных для ограничения (рестрикции) размножения фагов, рестриктаз I типа: у бактерий они узнают специфические последовательности чужеродной ДНК и режут обе цепи этой ДНК между случайными нуклеотидами. Ферменты же II типа режут там, где узнают, то есть работают предсказуемо. С их помощью Дэниел Натанс и Кэтлин Данна в 1971 году порезали ДНК вируса SV40 и показали, что получившийся набор фрагментов можно разделять электрофорезом в полиакриламидном геле [18], а значит, так можно картировать ДНК.
Рисунок 10. Благодаря им мы можем резать ДНК только там, где нужно. Слева — Дэниел Натанс, в центре — Гамильтон Смит, справа — Вернер Арбер. За вклад в познание биологической функции рестриктаз и за внедрение их в лабораторную практику в качестве молекулярных «ножниц закройщика» все трое удостоились Нобелевской премии.
Рестриктазы стали жизненно важным инструментом для генной инженерии. Они нашли применение не только в технологии рекомбинантных ДНК, но и в геномной дактилоскопии и техниках секвенирования (прочтения) нуклеотидных последовательностей [16], [19]. Первые рекомбинантные ДНК получили с помощью эндонуклеазы EcoRI, правда, группы Берга и Коэна использовали ее немного по-разному. В считаные годы спрос на эти ферменты так возрос, что академические энтузиасты, выделявшие уже известные и новые рестриктазы, перестали справляться со снабжением всех желающих, и тогда за дело взялись коммерсанты: в 1975-м — New England Biolabs, а позже и другие компании. К октябрю 2017 года было выделено уже 4 155 эндонуклеаз II типа. Найти всю информацию о них и системах рестрикции-модификации в целом можно в базе данных REBASE.
Как резать и сшивать ДНК, стало более или менее ясно, но оставалась проблема универсального (не узкоспециализированного типа конъюгации или трансдукции) внесения нуклеиновых кислот в клетки. У кишечной палочки давно было замечено нежелание поглощать ДНК из среды, но в 1970-м эту проблему разрешили Мортон Мандель и Акико Хига. Обработка клеток E. coli хлоридом кальция сделала их компетентными, то есть способными принимать генетический материал извне. Немного усовершенствованный, этот метод и сейчас широко используют для трансформации бактерий. В те же 70-е изучили трансформирующие свойства Ti-плазмид в отношении растительных клеток и применили микроинъекции, а в 80-е сконструировали электропоратор и генную пушку [20]. С появлением последней стало возможным интегрировать чужеродные гены в хлоропласты.
В 1972 году сотрудники Амстердамского университета Кес Ай и Пит Борст опробовали визуализацию ДНК с помощью электрофореза в агарозном геле с буфером, содержащим бромистый этидий. Это позволило видеть не меченные изотопами молекулы ДНК, просто положив гель на УФ-трансиллюминатор.
Как можно заметить, к технологии рекомбинатных ДНК шли разными путями: кто-то изучал биохимию кишечной палочки, кто-то — ее генетику с помощью бактериофагов, а кто-то — генетику млекопитающих с помощью их вирусов. И постепенно из мелких разнородных фрагментов сложилась общая картина устройства геномов, а заодно открылись и возможности манипулировать ими. Корнберг, например, делал ставку на E. coli, считая ее лучшей моделью для изучения более сложных эукариотических процессов. Своего ученика, Пола Берга, он призывал тоже заниматься бактериальной энзимологией, а не губить свою карьеру, продираясь сквозь генетические дебри млекопитающих. Но история, избрав выразителем своей воли Нобелевский комитет, решила, что правы были оба. При этом далеко не последнюю роль в их успехе и становлении генной инженерии сыграл. один холодильник: только в славном стэнфордском агрегате, именуемом «холодильник Корнберга», можно было найти всё необходимое для резки, склеивания и ретуширования ДНК [2].
Что было после?
Работы Берга и Коэна взбудоражили научный мир, обывателей и фондовые биржи (см. врезку «Генная инженерия и рынок») и открыли эру молекулярной биотехнологии. Уже в ближайшие годы начался отсчет полезных продуктов, полученных с помощью рекомбинантных ДНК. Но были решены далеко не все теоретические и практические задачи, и генная инженерия шаг за шагом, открытие за открытием, развивается по сей день.
В 1974 году Рудольф Йениш создал первое трансгенное млекопитающее — мышь, которой на раннем этапе эмбриогенеза встроили в ДНК ретровирус. Тогда и в дальнейшем «онкомышей» получали, конечно, не ради забавы, а ради выведения модельных линий для изучения канцерогенеза [21].
В 1975 году Фредерик Сенгер (рис. 11), до того занимавшийся установлением первичной структуры белков и РНК, разработал «плюс и минус» метод секвенирования ДНК, не слишком производительный, но в 1977-м усовершенствованный до «дидезокси-метода». Более быстрая и точная технология позволила группе Сенгера справиться с целым геномом бактериофага φX174. Тогда же Уолтер Гилберт и Аллан Максам разработали совершенно иной способ чтения ДНК, воспользовавшись подсказкой сотрудника Института молекулярной биологии им. В.А. Энгельгардта Андрея Мирзабекова, посетившего их лабораторию в 1975-м. Оба подхода требовали радиоактивного мечения ДНК. Метод Гилберта после отличного старта уступил первенство в покорении лабораторий методу Сенгера, и потому именно дидезокси-метод удостоился чести «читать» геном человека. С тех пор секвенирование стало еще проще и производительнее: хронологию появления новых техник и их описание можно найти в статье «Секвенирование нуклеиновых кислот» [16].
Рисунок 11. Благодаря им мы можем читать нуклеотидную последовательность ДНК. Слева — Фред Сенгер отмечает свою первую «нобелевку» — за секвенирование белка инсулина. Вторую он получит совместно с Гилбертом за разработку методов секвенирования ДНК. В центре — Андрей Дарьевич Мирзабеков занимался изучением динамики хроматина, разрабатывал микрочипы для анализа биомолекул, с 1989 по 1993 был вице-президентом организации «Геном человека» (HUGO). Справа — Уолтер Гилберт работал с Джеймсом Уотсоном, организовал несколько биомедицинских компаний и впервые озвучил термин «РНК-мир» [22].
В 1977 году американец Филлип Шарп и британец Ричард Робертс (рис. 12) независимо друг от друга обнаружили, что гены эукариот содержат длинные «смысловые паузы» — интроны, — которые затем вырезаются в процессе сплайсинга из незрелой мРНК. Эту проблему всегда приходится решать при экспрессии эукариотических генов в бактериях.
Рисунок 12. Нобелевские лауреаты Филлип Шарп и Ричард Робертс. Особенно известны как первооткрыватели интронов и инициаторы кампании 2016 года по подписанию нобелиатами открытого письма в защиту ГМО (см. врезку «Генная инженерия и рынок») от посягательств гринписовской братии. «Мы — ученые. Мы понимаем логику науки. Легко заметить, что то, что делает „Гринпис“, вредоносно и антинаучно. Вначале „Гринпис“, а затем и некоторые их союзники сознательно из кожи вон лезли, чтобы напугать людей. Это их способ добывать деньги. » (Р. Робертс, 2016)
На исходе 70-х разработали неизотопные методы мечения нуклеиновых кислот.
В 1978–1979 годах компания Genentech (см. врезку «Генная инженерия и рынок»), используя технологию рекомбинантных ДНК и E. coli в качестве биофабрики, получила первые в мире генно-инженерные лекарства — человеческие инсулин (Humulin) и гормон роста. С тех пор подобными способами созданы сотни биофармацевтических препаратов: гормонов, моноклональных антител, ферментов, генно-терапевтических молекул.
1982 год запомнился открытием рибозимов: Томас Чех и Сидни Альтман показали, что молекулы РНК могут обладать каталитической активностью. Помимо существенной поддержки гипотезы мира РНК, это открытие в 2000-х вылилось в создание инженерных рибозимов для генетической терапии, способных разрезать нужные РНК. Самым логичным выглядело их использование для блокирования ВИЧ и иных РНК-содержащих вирусов [23].
В 1983 году Кэри Мюллис совершил настоящую революцию в молекулярной биологии, разработав метод полимеразной цепной реакции (ПЦР). Теперь можно было легко получать нужные фрагменты ДНК в почти неограниченных количествах, а позже и оценивать с помощью ПЦР экспрессию генов. О почти неисчерпаемых возможностях метода и его новых итерациях подробно рассказывает статья «Полимеразная цепная реакция» [24].
В том же году появилось первое трансгенное растение: Майкл Беван, Ричард Флавелл и Мэри-Дэлл Чилтон модифицировали клетки табака с помощью Ti-плазмиды, несущей химерный ген антибиотикорезистентности.
В 1989-м удалось получить первую мышь с нокаутированными генами, крыс осилили гораздо позже — в 2003-м [25].
В 1990 году калифорнийские биологи пытались сделать цветки трансгенной петунии более яркими, а получили еще более бледные. Так неожиданно себя проявила РНК-интерференция, которую позже, в 1998 году, подробно описали у червя Caenorhabditis elegans Крейг Мелло и Эндрю Файер (рис. 13). Введением небольшой двухцепочечной РНК они вызвали сайленсинг (подавление экспрессии) генов, содержащих комплементарные этой РНК участки. Благодаря малым РНК, регулирующим экспрессию генов на посттранскрипционном уровне, удались на славу гипоаллергенные томаты, табак без никотина, кофе без кофеина и многое другое. Двухцепочечные молекулы оказались более эффективными, чем одноцепочечные (простые антисмысловые РНК), механизм действия которых не относят к интерференции.
Рисунок 13. Крейг Кэмерон Мелло и Эндрю Закари Файер, объяснившие, как можно без манипуляций с генами изменить количество их продуктов. «В мире так много сил, разделяющих людей, — языковой барьер, барьеры традиций, идеологий и верований. Наука противодействует всем этим силам, наука — это международное предприятие, которое нас уравнивает и объединяет для решения проблем и осознания нашего места в мире. Ведь действительно, она говорит нам, что мы обладаем глубокой общей историей как вид и, весьма вероятно, разделим общую судьбу как обитатели маленькой и уязвимой планеты» (К. Мелло, 2015)
В 1995-м секвенировали первый геном свободноживущего прокариота. Как ни странно, пионером стала Haemophilus influenzae, а не классическая модель, E. coli. Хромосому последней досеквенировали спустя два года, уже после прочтения куда более крупной первой эукариотической ДНК (Saccharomyces cerevisiae, 16 хромосом, 1996 год). Стратегии, разработанные для секвенирования дрожжевой ДНК, легли в основу других крупных проектов, включая «Геном человека» [26].
В 2000 году журнал Science опубликовал статью о разработке первого растения с повышенной пищевой ценностью — золотого риса, впоследствии изрядно нашумевшего (см. врезку «Генная инженерия и рынок») [29], [30]. Этот рис создавался для ликвидации смертельно опасного дефицита витамина А у населения бедных стран Азии и Африки. В ДНК обычного риса для этих целей ввели два чужеродных гена, совершенствующих синтез каротиноидов [29]. В 2005 году Syngenta анонсировала вторую итерацию золотого риса, накапливающую в зернах в 23 раза больше β-каротина. Масштабных посевов золотого риса придется еще подождать, а вот урожаи других генетически модифицированных культур собирают уже с середины 90-х. Сейчас в США бόльшая часть кукурузы, сои и хлопка содержит гены устойчивости к вредителям или гербицидам.
В 2007-м фармгигант Merck успешно завершил клинические исследования рекомбинантной вакцины Gardasil, защищающей от человеческих папилломавирусов высокого онкогенного риска, способных инактивировать гены опухолевых супрессоров и провоцировать развитие карцином шейки матки и некоторых других частей тела. Антигены вирусоподобных частиц, составляющих вакцину, производятся трансгенными дрожжами. Вскоре GlaxoSmithKline выпустила аналогичную, но более эффективную вакцину Cervarix.
В 2010-м сотрудники Института Дж. Крейга Вентера (JCVI), в числе которых были сам Вентер и Гамильтон Смит (рис. 14), создали первую бактерию с полностью синтетической генетической начинкой. Детище, названное Синтией, состояло из «тела» — клетки Mycoplasma capricolum, лишенной собственной хромосомы, — и «мозга» — ДНК, синтезированной по образу и подобию хромосомы Mycoplasma mycoides. В ряду клеточных поколений «мозг», как полагается, возобладал, и «тело» микоплазмы из capricolum превратилось в mycoides. В 2016-м коллектив получил похожую бактерию, но с сокращенным до возможного минимума числом генов (JCVI 3.0). Авторы работы объясняют эти упражнения потребностью в создании легко контролируемых микроорганизмов с полезными свойствами, хотя не все «лидеры мнений» считают такой путь самым подходящим [31–33].
Рисунок 14. Крейг Вентер и Джеф Д. Боеке, не рассчитывающие на милость природы и синтезирующие геномы самостоятельно. Вентер также известен как генератор коммерческих идей, а Боеке — как автор термина «ретротранспозон».
В 2011 году в России зарегистрировали первый генно-терапевтический препарат, причем отечественного дизайна — «Неоваскулген». Это плазмида, несущая ген фактора роста эндотелия сосудов (pCMV-VEGF165), предназначенная для стимулирования построения новых артерий у больных перемежающейся хромотой [34], [35].
В 2012 году Европейская комиссия впервые одобрила клиническое применение генно-терапевтического лекарства на территории ЕС. Препарат Glybera (алипоген типарвовек) создала компания uniQure для полного или долговременного исцеления пациентов с редким наследственным заболеванием — дефицитом липопротеинлипазы, изнуряющим постоянными приступами панкреатита. В 2016 европейское одобрение получил еще один препарат для генной терапии (см. врезку «Генная инженерия и рынок»). Американский регулятор, FDA, впервые одобрил два подобных препарата в 2017 году, оба — для персонализированного лечения B-клеточных лейкозов/лимфом. Первым стал педиатрический Kymriah (Novartis), вторым, уже подешевле и для взрослых, Yescarta (Kite Pharma, Gilead Science). В 2018 году «зеленый свет», скорее всего, получит и молекула с рабочим названием LUXTURNA (Spark Therapeutics) — первый препарат для борьбы с одной из форм наследственной дистрофии сетчатки.
Но 2012 год всё же запомнился другим, действительно прорывным событием: генно-инженерный арсенал пополнился новыми, удобными, точно настраиваемыми «ножницами» — CRISPR-Cas9. Ими можно разрезать выбранные последовательности ДНК не только в пробирке, но и прямо в живых клетках, то есть редактировать геномы in vivo. На подобное способны и другие инженерные нуклеазы — мегануклеазы (природные выделены в 90-х, постоянно совершенствуются), ZFN (получены в 1996) и TALEN (получены в 2011), — но с бόльшими затратами финансов и времени. История открытия и применения CRISPR-систем подробно рассказана в статье «CRISPR-эпопея и ее герои» [36]. Сайт-специфическими нуклеазами уже успели поработать с геномами организмов всех крупных таксонов, в том числе и человеческим.
В 2014 году с помощью ZFN модифицировали Т-лимфоциты инфицированных ВИЧ, чем снизили вирусную нагрузку. В 2015 безнадежной пациентке с лейкемией ввели донорские Т-лимфоциты, модифицированные с помощью TALEN, чем выиграли время для трансплантации костного мозга [37]. Тогда же в Китае покусились на редактирование генома нежизнеспособных эмбрионов CRISPR-системой [38]. В 2016 опухолевые клетки пациента с агрессивной карциномой легкого атаковали его собственными Т-лимфоцитами, подправленными CRISPR-Cas9 [39], [40]. Сейчас компания Sangamo Therapeutics (США) проводит набор участников I фазы клинических исследований ZNF-терапии in vivo: речь идет об исправлении дефектных генов, вызывающих мукополисахаридозы I/II и гемофилии А/В. Другой пионер отрасли, Editas Medicine, планирует начать клинические исследования CRISPR-терапии ex vivo и in vivo [39].
К 2014 году подоспела первая синтетическая и слегка усовершенствованная эукариотическая хромосома — хромосома III Saccharomyces cerevisiae. Поскольку руководитель проекта Джеф Боеке (рис. 14) не располагал финансами, сопоставимыми с возможностями «папаши» Синтии, Крейга Вентера, пришлось прибегнуть к остроумному решению — раздать работу по частям студентам Университета Джонса Хопкинса. Все остались довольны — и дешево, и публикация в Science иным студентам только снится [41], [42]! Международный проект Sc2.0, посвященный синтезу дрожжевого генома с заданными свойствами, уже близок к построению всех 16 хромосом.
В том же 2014-м Денис Малышев с коллегами из Исследовательского института Скриппс и New England Biolabs сконструировал кишечную палочку с расширенным генетическим алфавитом, которая стабильно поддерживает плазмиду с неприродной парой нуклеотидов [43]. В 2017 году эту полусинтетическую бактерию тюнинговали [44].
Развитие генетической инженерии шло одновременно многими путями. Его постоянно сопровождал нобелевский «медалепад» и пристальное внимание СМИ. Биологические процессы, с которыми имели дело генные инженеры, становилось всё сложнее объяснить общественности, а от этого рождались страхи и мифы, слишком далекие от разумных или даже гипертрофированных опасений специалистов (см. врезку «Рекомбинантные ДНК и биоэтика»). Технология рекомбинантных ДНК, ПЦР, синтетическая биология и редактирование геномов сулили просто невообразимые перспективы для человечества, а значит, из них можно было извлечь немало прибыли. Поэтому помимо решения этических вопросов академическим коллективам пришлось разбираться в вопросах монетизации и охраны интеллектуальной собственности (см. врезку «Генная инженерия и рынок»).
Ну а мы в следующей части статьи попробуем разобраться, как создают молекулярные химеры и как используют нуклеиновые кислоты для решения исследовательских и медицинских задач.
Рекомбинантные ДНК и биоэтика: наступить на горло собственной песне
Не успели первые химерные молекулы увидеть свет ламинара, как научная общественность озаботилась вопросами их биобезопасности. Вначале опасения касались онкогенной вирусной ДНК (Берг даже заставил сотрудников регулярно искать в своей крови антитела к вирусу SV40), а затем и генов устойчивости к антибиотикам в составе рекомбинантных ДНК. Специально созванный Бергом комитет при участии Бойера, Коэна и других пионеров отрасли составил список рекомендаций по работе с подобными молекулами. В их числе было и предложение добровольного моратория на внесение генов резистентности в бактерии, изначально не обладающие таким свойством, и на внедрение ДНК вирусов животных в плазмиды. Эти рекомендации в виде письма «Потенциальная биологическая опасность рекомбинантных ДНК» в июле 1974 опубликовали PNAS, Science и Nature [45].
Самое интересное, что еще в мае того же года в New York Times вышла вполне благожелательная статья об успешном переносе генов животных в бактериальные клетки и впечатляющих перспективах новой технологии в медицине и сельском хозяйстве. Тем не менее пресс-конференция Национальной академии наук, посвященная анонсированию моратория, сумела сместить фокус общественного внимания с новых возможностей на новые риски. Сама собой напрашивалась мысль: «Раз уж сами исследователи обеспокоились, значит, опасность должна быть действительно ужасающей» [7]. Беспрецедентную попытку ученых ограничить собственные исследования ради предупреждения мало- или вовсе невероятных рисков обыватели с непривычки восприняли как сигнал к обороне, обороне от научного безумства. Основания для беспокойства у них были, ведь, например, еще совсем недавно величайшими открытиями рубежа 19–20 веков — рентгеновскими лучами и радиоактивными элементами — их лечили от прыщей и волосатости в косметических салонах. Разумеется, добровольный мораторий не удовлетворил общественность и чиновников, и молекулярных биологов заставили вступить в изматывающие публичные дебаты.
Благодаря этическим мукам биологов небольшое рекреационное местечко под калифорнийским Монтереем обрело мировую известность. Кто-то еще не слышал слово «Асиломар»? Оно стало нарицательным для обозначения мероприятий, где отраслевые эксперты, юристы и пресса обсуждают этические дилеммы, связанные с какими-то революционными научными событиями. Дело в том, что в Асиломарском конференц-центре 24–27 февраля 1975 года состоялась крупная международная встреча по проблеме рекомбинантных ДНК, на которой эксперименты с ними договорились продолжить, но с рядом ограничений. Три с половиной дня «Асиломара» подробно описаны в книге [46]. Соглашения, достигнутые на конференции, легли в основу рекомендаций Национального института здоровья США и регуляторов других стран. Рекомендации по профилактике гипотетического вреда гибридных ДНК для человека и природы включали использование специальных вытяжных систем и биологических барьеров, предупреждающих «побег» экспериментальных организмов и их выживание вне лаборатории. Уместным сочли и правительственный надзор — пока не подтвердится безопасность технологии. С тех пор провели сотни миллионов (!) экспериментов с рекомбинантными молекулами, но ничего дурного так и не произошло [47]. Сейчас строгому регулированию подвергаются все ГМО, правда, к ним не относятся объекты, из генома которых что-то вырезано, но не заменено ничем чужеродным.
Перспективы применения CRISPR-технологии в отношении ДНК эмбрионов [38] снова всколыхнули общественность. В январе 2015 года состоялся «новый Асиломар» — встреча в Напе (Калифорния), на которой обсудили перспективы и допустимые границы применения технологий геномного редактирования. В декабре того же года состоялся Международный саммит по редактированию человеческих генов [48]. Часть ученых высказалась против манипуляций с клетками зародышевой линии в принципе: их смущает и любимый обывателями призрак дизайнерских детей, и возможное усиление социального неравенства, и несовершенство технологий. Другие считают, что пока просто нельзя допускать развитие модифицированных клеток в полноценный организм [49]. Но если технология геномного редактирования станет достаточно эффективной и безопасной, неужели не стόит избавлять потомство от тяжелейших генетических недугов типа болезни Хантингтона, а государственные и семейные бюджеты — от постоянно растущего бремени содержания неизлечимых больных? В любом случае, раз технологию нельзя «разоткрыть», из нее надо контролируемо извлечь безопасный максимум. Это сумели понять в Великобритании, официально разрешив редактировать геномы человеческих эмбрионов. Более семи дней зиготам развиваться не дадут (лицензия не позволяет больше четырнадцати дней), однако и этого должно хватить, чтобы наконец-то разобраться в раннем развитии человека и причинах невынашивания плода [50]. Подобные планы можно реализовать в Китае, Швеции и США.
Генная инженерия и рынок: найти ключ к монетизации научных достижений
Любимые многими нашими не-учеными мечты о всегда голодных молодых ученых вряд ли нашли бы понимание у пионеров генной инженерии. Они были заняты не поиском пропитания, а интересной работой — в нормальных условиях и под руководством талантливых ученых. В итоге многие получили Нобелевские премии и миллионные состояния. А благодаря патентно-лицензионной системе миллионы они принесли и своим институтам, чтобы те лучше финансировали новые исследования.
Американская академическая наука вступила в фазу коммерциализации. Сотрудники институтов активно налаживали связи с мировым капиталом, в том числе и организуя собственные биотехнологические компании. С 1980 по 1985 в США появилось более 400 подобных фирм. Этому благоприятствовали налоговые льготы и крупные навары с биржевых операций. На запах денег слетелись и представители Большой фармы. В Европе инвестиционный климат был похуже, но и там процесс быстро набрал обороты. Япония объявила биотехнологию национальным приоритетом, и, подучившись у американских биотехнологов, пополнила ряды лидеров индустрии. Другие страны тоже осознали стратегическую важность отрасли и по мере возможности старались уделять ей внимание [51]. Мы не будем пытаться объять необъятное, разбирая все генетические коммерческие проекты, а устроим маленькую историческую экскурсию по избранным, крупным перекресткам академической науки и генно-инженерной индустрии.
. В 1980 году Верховный суд США разбирал дело «Даймонд против Чакрабарти»: Сидни Даймонд, служащий Ведомства по патентам и товарным знакам США, выступал против выдачи патента на живой организм микробиологу Чакрабарти. Ананда Чакрабарти ввел в псевдомонаду сразу несколько плазмид, повышающих ее «аппетит» — способность к утилизации разных углеводородов нефти. Суд вынес решение в пользу Чакрабарти, поскольку хоть раньше живые организмы и не патентовали, новые научные реалии сделали это возможным: интеллектуальной собственностью могли стать организмы, полученные инженерным путем. После бактерий начали патентовать всё модифицированное, вплоть до раковых клеток человека.
В 1978 году Калифорнийский университет оформил первую заявку на патентование гена — гена человеческого соматотропина. С тех пор было запатентовано 4 300 человеческих генов. В 2013 году Верховный суд США, рассмотрев дело «Ассоциация молекулярных патологов против Myriad Genetics», постановил, что выделенные кем-то гены не могут быть объектом патентования, поскольку относятся к «натурпродуктам», а вот кДНК (комплементарная ДНК) — может, так как получается «искусственно». Это решение поддержал и нобелевский лауреат Джеймс Уотсон. Так Myriad Genetics лишилась долго и активно оберегаемой ими монополии на выявление вариантов BRCA-генов, предрасполагающих к раку молочной железы и яичников [52]. Это постановление, по сути, отменяло действие патентов и на другие гены. Такое же решение относительно гена BRCA-1 в 2015 году вынес Верховный суд Австралии, рассмотрев дело «Ивонн Д’Арси против Myriad Genetics». Подавая иск против компании, Ивонн, не единожды испытавшая на себе тяготы онкозаболевания, надеялась сделать онкодиагностику доступнее.
Одним из основателей Myriad Genetics был пионер секвенирования Уолтер Гилберт. Он же известен как соучредитель биотехнологического гиганта Biogen и компании Paratek Pharmaceuticals, а еще как один из первых апологетов секвенирования человеческого генома. Еще до старта известного международного проекта он анонсировал открытие Genome Corporation, в составе которой планировал первым прочитать геном человека и затем продавать расшифрованную информацию.
Примерно такие же цели преследовала компания Celera Genomics, основанная Крейгом Вентером и Гамильтоном Смитом. Она стала той самой «конкурирующей организацией», которая значительно ускорила завершение проекта «Геном человека», более процессивным способом секвенировав «второй» человеческий геном, а точнее — пять геномов, включая ДНК самого Вентера. Запатентовать прочтенную информацию компании так и не удалось. Свой следующий коммерческий проект, Synthetic Genomics, Вентер и Смит посвятили, конечно же, синтетической биологии. Компания сотрудничает с энергетическими гигантами типа BP и Exxon Mobil, разрабатывая штаммы микроорганизмов для ликвидации нефтяных пятен и синтеза биотоплива. В последние годы интересы компании расширились до трансплантации органов и производства вакцин и продуктов питания. В 2013 году Вентер с партнерами создал компанию Human Longevity. Этот проект преследует цель построить крупнейшую базу данных по геномам и фенотипам и, используя преимущества машинного обучения, упрочить доказательную базу антивозрастной медицины. Помимо исследований, на которые изыскиваются многомиллионные инвестиции, Human Longevity проводит коммерческое медицинское тестирование, позволяющее выявить у клиента его предрасположенность к типичным возрастзависимым недугам и «поймать» их на ранних стадиях. Помимо коммерческих компаний Вентер организовал два исследовательских института и не раз попадал в годовые рейтинги самых влиятельных персон в мире.
Удачный пример синтеза академической науки и фарминдустрии показали Артур Корнберг [15], Пол Берг и Чарльз Янофски, в 1980-м основав DNAX — институт молекулярной и клеточной биологии, который почти сразу приобрела компания Schering-Plough Pharmaceuticals (сейчас — часть Merck & Co.). DNAX предоставлял отличные кадры для разработки препаратов, и эти кадры не были ограничены в правах публикации своих результатов [53].
Крейг Мелло, одним из первых описавший РНК-войны [54], помимо основания успешной биофармацевтической компании RXi Pharmaceuticals занялся укреплением здоровья пчел с помощью РНК-интерференции. Специально созданная для этого израильско-американская фирма Beeologics в 2011 году была поглощена Monsanto.
Курс второго одобренного Еврокомиссией генно-терапевтического препарата, «Стримвелиса» (Strimvelis, GlaxoSmithKline и партнеры), стоит примерно в два раза дешевле. Эта технология корректирует ex vivo гематопоэтические стволовые клетки больных тяжелым комбинированным иммунодефицитом, вызванным нехваткой аденозиндеаминазы. В 2017 году «Стримвелис» нашел своего первого пациента. Как заявляют представители GlaxoSmithKline, на большой навар от этой разработки они даже не рассчитывают, ведь она лечит редкую болезнь и, как любая генетическая терапия, устраняет причину недуга, чем исключает «подсаживание на фармиглу». Это явно не то, что может осчастливить венчурных капиталистов в краткосрочной перспективе, однако фармгиганты могут себе позволить подобное «баловство», потому что их доходы формируются множеством других товаров [55].
Осознание возможностей применения технологии CRISPR-Cas в научных исследованиях и медицине спровоцировали беспрецедентно жестокий для академических организаций патентный спор. Дженнифер Дудна и ее коллеги из Калифорнийского университета в Беркли подали заявку на патентование технологии CRISPR-Cas9 первыми, однако благодаря привилегированному рассмотрению похожей заявки Фэна Чжана из Института Броудов (Кембридж), именно Чжану в 2014 году выдали первый CRISPR-патент [36]. Калифорнийский университет с этим громко не согласился, и только в феврале 2017 года суд наконец постановил, что патенты двух коллективов не противоречат друг другу: Дудна в своей заявке описывала конструирование РНК-гида, а Чжан — применение CRISPR-Cas9 в эукариотических клетках. Поэтому патент 2014 года остался в силе. Тем не менее вторая сторона считает, что их права охватывают применение CRISPR-Cas9 в любых системах. Теперь желающим приобрести лицензии по этой технологии не ясно, нужно ли платить двум университетам сразу. Если да, то CRISPR-технология может лишиться важного преимущества — дешевизны [56]. Правда, нужно сказать, что CRISPR-реагентами группа Чжана уже четыре года бескорыстно делится с «некоммерческими» биологами через Addgene. В целом же CRISPR-технология обрастает патентами с катастрофической скоростью.
В феврале 2017-го тот же Институт Броудов получил первый европейский патент, связанный с системой CRISPR-Cpf1. Патентами и лицензиями защищены права на применение и других дизайнерских ферментов. Например, получать «цинковыми пальцами» (ZFN) любые терапевтические молекулы может сам разработчик технологии, Sangamo, делать лекарства от отдельных болезней могут Pfizer и еще пара компаний, использовать ZFN для удовлетворения исследовательских нужд разрешено Sigma Aldrich, а модифицировать растения — Dow AgroSciences.
К счастью, рекомбинантные ДНК участвуют в рождении и некоммерческих продуктов. Самым известным из них можно назвать многострадальный золотой рис (Golden Rice). Работу по его созданию вел Международный исследовательский институт риса, а частично финансировал Фонд Билла и Мелинды Гейтсов. Как ни странно, экспериментальные плантации этого риса, предназначенного для спасения населения беднейших стран от тяжелого гиповитаминоза, раздражают самих страждущих и подвергаются их разорительным набегам. Подобные акции многие объясняют если не прямым подстрекательством, то «промыванием мозгов» со стороны гринписовцев и им подобных (рис. 15). В 2016 году ученые составили открытое письмо, адресованное «Гринпис», с требованием прекратить анти-ГМО-кампанию в целом и антирисовую в частности. К осени следующего года его подписали 126 нобелевских лауреатов и более 13 тысяч прочих граждан. Конечно, вряд ли кто-то ожидает понимания со стороны гринписовцев, давно (и не без оснований) считающих золотой рис мертворожденным, просто нобелиаты прекрасно осознают, что их голос звучит громче, и потому пытаются донести до широкой общественности свое мнение относительно ГМО.
Рисунок 15. Битва за эмоции. Слева — Анти-ГМО: «Франкенпища: укуси ее, пока она не укусила тебя». Справа — Анти-анти-ГМО: «Спасибо, „Гринпис“, за то, что спасла нас от золотого риса».
Даже в США, где поля ГМ-культур — давно привычный элемент пейзажа, прекрасные проекты проигрывают общественным страхам. Во Флориде бактериальная пятнистость томатов — чуть ли не самое опасное для этой культуры заболевание. Поиск «обычных» способов борьбы с ним обходится в десятки миллионов долларов, а пока фермеры до 44 раз в год опрыскивают растения медь-содержащими пестицидами, которые, накапливаясь в земле, могут вредить почвенной микробиоте и поступать в грунтовые воды. Ученые решили проблему бактериальной пятнистости и удвоили урожайность с помощью внедрения в томаты гена устойчивости Bs2 из сладкого перца. Тем не менее участники многолетнего проекта — 2Blades Foundation, Калифорнийский университет в Беркли и Университет Флориды — не могут найти инвесторов для вывода своей разработки на рынок: осилить оплату всех проверок ГМО для получения одобрения Минсельхоза, как правило, могут лишь агрогиганты. Инвестировать в ГМ-томаты первым никто не хочет. И дело не в том, что фермеры настолько глупы, чтобы не осознать все плюсы разработки. Нет, просто рестораны и сетевые магазины, закупающие у них продукцию, требуют в контрактах заверения, что она генетически не модифицирована. И не то чтобы они сами питали какие-то иллюзии на этот счет — просто так хочет массовый потребитель, воспитанный в анти-ГМО-атмосфере [57]. Тот самый потребитель, который не знает, что в «обычной» пище тоже содержатся гены. Недавний опрос, организованный Мичиганским государственным университетом, выявил, что из тысячи американцев этого не знают почти 40%, причем таких больше среди молодых, обеспеченных и считающих себя компетентными в продовольственной теме. Лишь 59% доверяют в вопросах пищевой безопасности академическим ученым, 49% — правительственным, 33% — промышленным. Мнение всех этих ученых часто проигрывает в конкурентной борьбе со словом друзей, родственников, рекламодателей и звезд шоу-бизнеса.