Геморрагический синдром что это у женщин в гинекологии
Геморрагический синдром
Клиническая характеристика геморрагического синдрома
| I.Гематомный тип (нарушение внутреннего пути свертывания коагуляционного гемостаза) | II.Петехиально-пятнистый (микроциркуляторный) тип (нарушение тромбоцитаного звена гемостаза, внешнего пути свертывания коагуляционного гемостаза) | III.Смешанный (синячково-гематомный) тип (сочетанное нарушение и тромбоцитарного и коагуляционного звена гемостаза) |
(патология микрососудистого русла)
(локальная сосудистая патология)
Симптомы геморрагического синдрома
Характер и локализация кожных высыпаний при геморрагическом синдроме определяют симптоматику данной патологии.
Основной симптом – длительные кровотечения, возникающие как следствие травмы или изнуряющей физической нагрузки, сильного перенапряжения, переохлаждения или перегревания, которые могут также происходить самопроизвольно.
В каждом пятом случае патологии наблюдается сыпь различного характера, могут появляться как мелкие петехии, так и крупные гематомы некротических форм, возможно возникновение ангиэктазий.
Геморрагический синдром может стать следствием приема лекарственных препаратов, которые влияют на естественные процессы тромбоцитов и понижают свертываемость крови. Кроме того, у пациентов, страдающих болезнью Верльгофа, гемофилией и дефицитом протромбина также может наблюдаться данная патология.
Проявления геморрагического синдрома
Разновидности геморрагического синдрома
Нарушение внутреннего пути свертывания коагуляционного гемостаза (гематомный тип кровоточивости)
Врожденная и приобретенная афибриногенемия
Нарушение тромбоцитарного звена гемостаза, внешнего пути свертывания коагуляционного гемостаза (петехиально-пятнистый тип кровоточивости)
Тромбоцитопения
Тромбоцитопатия
Дефицит факторов II,V,VII,XI
Cочетанное нарушение тромбоцитарного и коагуляционного звена гемостаза (смешанный (синячково-гематомный) тип кровоточивости)
Диссеминированное внутрисосудистое свёртывание
Болезнь Виллебранда
Патология микрососудистого русла (васкулитно-пурпурный тип кровоточивости)
Кровоточивость петехиальная с эксудативно-воспалительными явлениями, очагами некроза, гематурия, артралгия, кровоточивость слизистых.
Геморрагический васкулит
Ангиоматозные кровотечения
Диагностика геморрагического синдрома
Вовремя установленный диагноз поможет специалисту назначить эффективное лечение, а вам – сделать свои сосуды здоровыми раз и навсегда. Подтвердить или опровергнуть диагноз можно, сдав ряд лабораторных анализов, направленных на получение детальной информации о состоянии крови. Также понадобится провести коагуляционные тесты, во время спорных ситуаций врач-диагност может взять стернальную пункцию для углубленной диагностики.
После получения полной картины заболевания, определения ее стадии, причин и степени тяжести геморрагического синдрома, будет назначено лечение.
Лечение геморрагического синдрома
Основой выбора метода лечения геморрагического синдрома является определение причины заболевания, однако существуют следующие ключевые принципы:
Профилактика геморрагического синдрома
Важнейшей и основополагающей частью предупреждения геморрагического синдрома является полное медицинское обследование для своевременного установления и устранения его возможных причин.
Новорожденным недоношенным детям необходимо введение подкожно витамина К и прикладывание ребенка к груди как можно скорее после рождения.
Диетическое питание пациентов, склонных в данной патологии, должно быть основано на усиленном потреблении витамина К, а также белков, овощей и фруктов. Кроме того, таким людям необходимо избегать физической активности, приводящей к возникновению травм и ранений.
Геморрагический цистит у женщин: диагностика и лечение
Коллектив авторов:
Лечение инфекций мочевых путей (ИМП) зачастую является сложной задачей, что в большинстве случаев обусловлено трудностями диагностики причин развития ИМП и выявления факторов риска, приводящих к постоянному рецидивированию заболевания. При первом посещении врач не может ответить на вопрос: является ли данный эпизод инфекции неосложненной ИМП? Ведь только обследовав пациентку, можно установить причину развития дизурии, болей над лоном, макрогематурии и т.д. и назначить терапию согласно принятым рекомендациям. Только такой подход позволит избежать бесконтрольного приема антимикробных препаратов, в том числе и фторхинолонов, развития анитбиотикорезистентности, перехода инфекции в хроническую форму, нарушения нормального биоценоза кишечника и влагалища.
Бактерии семейства Enterobacterales являются наиболее частым этиологическим агентом развития ИМП, однако в ряде случаев никакого бактериального агента выявить не удается, а основным клиническим признаком наравне с дизурией является макрогематурия [1, 2]. В настоящее время все большее внимание уделяется влиянию вирусных инфекций на развитие ИМП как у взрослых, так и у детей [3–9]. Явление вирусурии также достаточно активно обсуждается в литературе [3–12]. По данным различных авторов, вирусы группы герпес-вирусов, папилломавирусов, аденовирусов могут являться причиной развития стойкой дизурии [5, 13]. Следует отметить, что герпес-вирусы: вирус простого герпеса (ВПГ) 1 и 2 типов, цитомегаловирус (ЦМВ), вирус Эпштейна–Барра (ВЭБ) способны вызывать вторичную иммуносупрессию и усугублять течение бактериальной инфекции, приводя к развитию рецидивов [11, 12, 14]. Прием антимикробных препаратов при наличии вирусной составляющей еще больше усугубляет процесс за счет подавления нормальной флоры.
Цель: изучить причины возникновения геморрагических циститов, разработать алгоритм обследования указанных пациенток, а также подобрать рациональную терапию.
Материалы и методы
В урологическое отделение ГБУЗ «ГКБ им. В.П. Демихова ДЗМ» за 2019 г. была госпитализирована 61 пациентка с клинической картиной острого геморрагического цистита в возрасте от 18 до 89 лет (средний возраст составил 55,56 ± 21,82). Это составляет 59,2% от всех пациенток, госпитализированных в отделение по поводу воспалительных заболеваний нижних мочевых путей. Больным проводилось стандартное обследование: общий анализ мочи, посев мочи на флору и чувствительность к антибиотикам, ультразвуковое исследование почек и мочевого пузыря, цистоскопия по показаниям.
Учитывая высокую частоту наличия вирусных инфекций как этиологического фактора развития геморрагического цистита на базе кафедры урологии и хирургической андрологии ГБОУ ДПО РМАНПО Минздрава России был разработан алгоритм обследования указанной категории больных, дополнительно включающий метод полимеразной цепной реакции (ПЦР) первой порции мочи (соскоба из уретры) на наличие ВРГ 1 и 2 типов, ЦМВ, ВЭБ в период обострения, иммуноферментный анализ (ИФА) с определением иммуноглобулинов G и M к ВПГ 1 и 2 типов, ЦМВ и ВЭБ, посев отделяемого из влагалища на флору и чувствительность к антибиотикам с обязательным указанием количества лактобацилл.
По данному алгоритму на базе кафедры урологии и хирургической андрологии ГБОУ ДПО РМАНПО Минздрава России было обследовано 214 пациенток, из них 154 (72%) пациентки были в возрасте от 18 до 44 лет.
Результаты
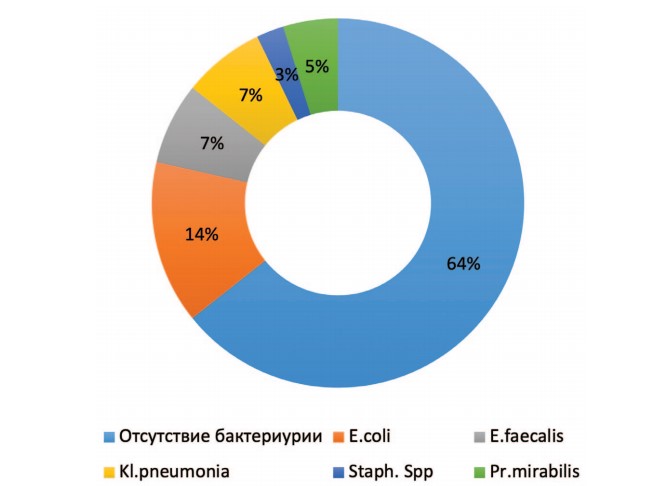
При обследовании 61 пациентки в урологическом отделении ГБУЗ «ГКБ им. В.П. Демихова ДЗМ» выявлено, что передозировка антикоагулянтов у пациенток пожилого возраста, имеющих отягощенный кардиологический, неврологический анамнез (фибрилляция предсердий, хроническая ишемия головного мозга, перенесенное острое нарушение мозгового кровообращения и т. д.) как причина развития макрогематурии и дизурических явлений, имела место в 18% случаев (11 больных). Постлучевой цистит (лучевая терапия по поводу рака шейки матки в 2 случаях и рака влагалища у 1 пациентки) был у трех больных. Им выполнена трансуретральная резекция стенки мочевого пузыря и коагуляция кровоточащих сосудов). В двух случаях анамнестически имелась опухоль мочевого пузыря, однако гистологически рецидив опухоли не подтвержден. В остальных случаях пациентки заболели остро и в связи с выраженной дизурией и макрогематурией были госпитализированы в урологическое отделение (рис. 1).
Рис. 1. Данные бактериологического анализа мочи
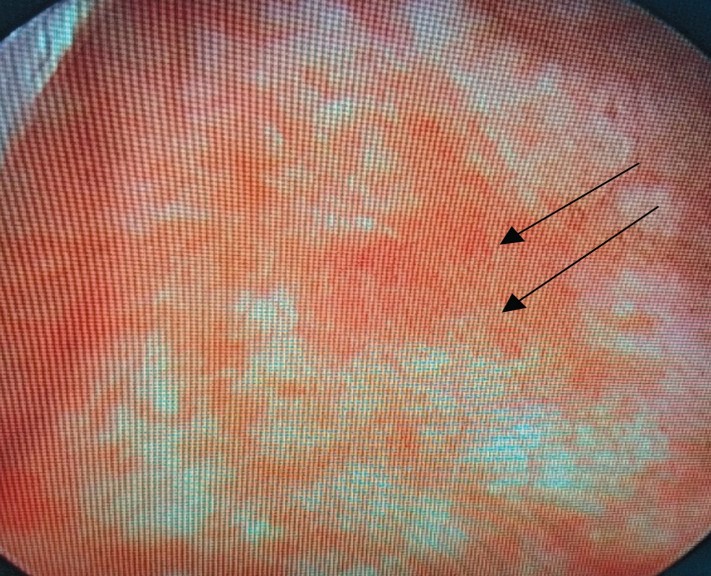
Отсутствие лейкоцитурии и бактериурии, наличие микро- или макрогематурии, стерильные посевы мочи, изменения, характерные для вирусного поражения стенки мочевого пузыря в виде множественных петехиальных кровоизлияний, выявленные нами при цистоскопии, позволили нам предположить именно вирусную этиологию заболевания (рис. 2).
Рис. 2. Цистоскопическая картина геморрагического цистита. Множественные петехиальные кровоизлияния
И таким образом доля геморрагических циститов предположительно вирусной этиологии, вирусных уретритов в структуре воспалительных заболеваний нижних мочевых путей увеличивается, что диктует необходимость создания
Пациентки с геморрагическим циститом не нуждаются в госпитализации, однако наличие гематурии вызывает беспокойство и, как правило, они настаивают на госпитализации для исключения опухолевого процесса.
И таким образом доля геморрагических циститов предположительно вирусной этиологии, вирусных уретритов в структуре воспалительных заболеваний нижних мочевых путей увеличивается, что диктует необходимость создания потенциально нового алгоритма обследования этой категории больных и этиологически обоснованной терапии.
Подобный алгоритм был разработан на базе кафедры урологии и хирургической андрологии ГБОУ ДПО РМАНПО МЗ РФ (табл. 1).
Таблица 1. Алгоритм диагностики рецидивирующих (геморрагических) циститов
ТЩАТЕЛЬНО СОБРАННЫЙ АНАМНЕЗ!
С выявлением таких факторов риска, как раннее начало половой жизни, частая смена половых партнеров, наличие инвазивных манипуляций, сопутствующие хронические гинекологические заболевания, дисбиозы влагалища. Наличие вирусных инфекций (лабиального и генитального герпеса, ЦМВ, ВЭБ, вируса папилломы человека (ВПЧ) как высокого, так и низкого онкогенного риска) у пациентки и ее половых партнеров. Наличие эрозии шейки матки, ассоциированной с ВПЧ и/или дисплазия эпителия (CIN) II–III ст, ВПЧ(+)
Наличие хронической герпесвирусной латентной инфекции (ХГВИ) выявлено у 83 (37%) из 214 обследованных пациенток на кафедре урологии и хирургической андрологии, что подтверждено данными анамнеза, результатами ИФА с увеличением уровня иммуноглобулинов G в десятки и сотни раз. Уровень антител к ВПГ 1 и 2 типов у пациенток с геморрагическим циститом без лейкоцитурии и стерильным бактериологическим посевом мочи достоверно выше, чем у пациенток с геморрагическим циститом и выявленным возбудителем в 2,6 раз (р
Геморрагический синдром что это у женщин в гинекологии
Среди многочисленных вариантов лечения ММ у женщин фертильного возраста предпочтение отдается органосохраняющим методам, включающим консервативную миомэктомию с помощью гистероскопии, лапароскопии и лапаротомии, эмболизацию маточных артерий, дистанционное разрушение опухоли MR-контролируемым фокусированным ультразвуком (ФУЗ-абляция миоматозных узлов).Но даже использование малоинвазивных органосберегающих хирургических методик не гарантирует 100% эффективности лечения. Литературные источники утверждают, что вероятность рецидива заболевания после консервативной миомэктомии в течение 5 лет составляет 45-55% [14; 15]. А удельный вес выполняемых гистерэктомий при ММ в структуре оперативных вмешательств достигает 60,9-95,3% [3].В связи с этим приоритет при лечении ММ остается за гормональной терапией, используемой как в качестве нео- и адъювантной, так и самостоятельного варианта лечения[2; 3; 7; 9;12]. Однако, несмотря на огромный выбор гормональных препаратов, нередко на фоне их применения у пациенток с ММ отмечаются побочные эффекты и осложнения (нарушения менструального цикла, метроррагии, увеличение размеров миоматозных узлов), что диктует необходимость дальнейшего изучения патогенетических особенностей течения заболевания для оптимизации существующих методов консервативной терапии.
Цель исследования: изучить особенности иммунной системы и причины ее дисфункции у больных миомой матки, осложненной геморрагическим синдромом.
Материал и методы исследования: под нашим наблюдением находилось 76женщин с ММ, размеры которой не превышали 12-недельную беременность, с преимущественно интрамуральной и субсерозной локализацией узлов, и имеющей показания для консервативного лечения. Основную группу составили 43 пациентки с ММ и клиникой геморрагического синдрома на фоне гормонотерапии. В группе сравнения (n=33)осложнений при консервативном лечении ММ гормональными препаратами не наблюдалось. Контрольная группа была представлена практически здоровыми женщинами (n=27). Всем пациенткам проводилось стандартное клинико-лабораторное обследование и ультразвуковое сканирование абдоминальным и вагинальным датчикомна аппарате HITACHI-5500 с применением широкополосных, сверхвысокоплотных конвексных датчиков 3,5-5,0 МГц и полостных датчиков 5,0-7,5 МГц. Состояние иммунной системы оценивали по содержанию цитокинов в сыворотке крови женщин. Исследование проводили методом твердофазного иммуноанализа. Для определения интерлейкинов (ИЛ-1β, ИЛ-4, ИЛ-6), интерферона(γ-ИНФ) ифактора некроза опухоли (ФНО-α) использовали наборы реактивов «Вектор-БЕСТ», г.Новосибирск. Для определения интерлейкина ИЛ-2 использовали набор реактивов фирмы Biosource, USA. Для определения Fas-лиганда(Fas-L) использовали набор реактивов фирмы Medsystems, Австрия. Дополнительно проводили обследование на выявление антителIgGиIgM к возбудителям урогенитальных инфекций (хламидиоз, уреаплазмоз, трихомониаз, цитомегаловирусной и герпетической инфекций) с помощью иммуноферментного анализа (ИФА).
Статистическая обработка результатов исследования проведена с использованием пакета прикладных программ Statgraphics (Statistical Graphics System), разработанного фирмой STSC Inc.
Результаты исследования и их обсуждение. Возраст обследованных варьировал от 21 до 42 лет и в среднем составил в основной группе – 30,5±4,3 года, в группе сравнения – 31,2±5,4 года, в контрольной группе – 30,2±5,5 года, что не имело значимых межгрупповых различий. Общая характеристика групп представлена в таблице 1. Детальное изучение анамнеза показало высокую частоту генитальной патологии у больных с ММ (табл. 1). Удельный вес хронических воспалительных заболеваний половых органов в основной группе и в группе сравнения превышал показатель контрольной группы в 8 раз, нарушений менструального цикла по типу гиперменореи, полименореи, мено- и метроррагии – в 20 раз, доброкачественных заболеваний шейки матки – в 18 раз. Использование с целью контрацепции внутриматочных спиралей (ВМС) прослежено только в группах женщин с ММ. Кроме того, необходимо отметить, что реализовать репродуктивную функцию смогла лишь каждая вторая пациентка с ММ, в то время как в группе контроля превалировали рожавшие женщины, а частота самопроизвольных абортов была значительно выше у больных основной группы и группы сравнения (табл. 1).
Общая характеристика групп обследованных женщин
Апоплексия яичника
Апоплексия яичника (apoplexia ovarii) определяется как внезапно наступившее кровоизлияние в яичник при разрыве сосудов фолликула, стромы яичника, фолликулярной кисты или кисты желтого тела, сопровождающемся нарушением целостности его ткани и кровотечением в брюшную полость.
Апоплексия яичника встречается в любом возрасте (до 45-50 лет). Частота апоплексии яичника среди гинекологической патологии составляет 1-3 %. Рецидив заболевания достигает 42-69%.
Апоплексия имеет сложный патогенез, обусловленный физиологическими циклическими изменениями кровенаполнения органов малого таза. Большинство исследователей выделяют «критические моменты» для повреждения яичника. Так, у 90-94% больных апоплексия яичника происходит в середину и во вторую фазу менструального цикла. Это связано с особенностями яичниковой ткани, в частности с повышенной проницаемостью сосудов и увеличением их кровенаполнения в период овуляции и перед менструацией.
Важная роль в возникновении апоплексии яичника принадлежит дисфункции высших отделов нервной системы, стрессовым ситуациям, психоэмоциональной лабильности, воздействию экологических факторов.
Выделяют болевую, геморрагическую (анемическую) и смешанную формы апоплексии яичника.
Клиника и диагностика. Основным клиническим симптомом апоплексии яичника является внезапная боль в нижних отделах живота. Боль связывают с раздражением рецепторного поля яичниковой ткани и воздействием на брюшину излившейся крови, а также со спазмом в бассейне яичниковой артерии.
Слабость, головокружение, тошнота, рвота, обморочное состояние определяются внутрибрюшной кровопотерей.
Болевая форма апоплексии яичника наблюдается при кровоизлиянии в ткань фолликула или желтого тела. Заболевание манифестирует приступом болей внизу живота без иррадиации, иногда с тошнотой и рвотой. Признаков внутрибрюшного кровотечения нет.
Клиническая картина болевой и легкой геморрагической формы апоплексии яичника сходна.
В клинической картине средней и тяжелой геморрагической (анемической) формы апоплексии яичника основные симптомы связаны с внутрибрюшным кровотечением. Заболевание начинается остро, часто связано с внешними причинами (половой акт, физическое напряжение, травма и т.д.). Боль в нижних отделах живота часто иррадиирует в задний проход, ногу, крестец, наружные половые органы, сопровождается слабостью, головокружением, тошнотой, рвотой, обмороками. Выраженность симптоматики зависит от величины внутрибрюшной кровопотери.
В клиническом анализе крови отмечается снижение уровня гемоглобина, но при острой кровопотере в первые часы возможно повышение уровня гемоглобина в результате сгущения крови. У некоторых больных выявляется незначительное увеличение лейкоцитов без сдвига формулы влево.
При УЗИ внутренних гениталий определяется значительное количество свободной мелко- и среднедисперсной жидкости в брюшной полости со структурами неправильной формы, повышенной эхогенности (кровяные сгустки).
Для диагностики заболевания без выраженных нарушений гемодинамических показателей применяют пункцию брюшной полости через задний свод влагалища. Однако методом выбора в диагностике апоплексии яичника стала лапароскопия. Апоплексия яичника при лапароскопии выглядит как стигма овуляции (приподнятое над поверхностью небольшое пятно диаметром 0,2-0,5 см с признаками кровотечения или прикрытое сгустком крови), в виде кисты желтого тела в «спавшемся» состоянии либо в виде самого желтого тела с линейным разрывом или округлым дефектом ткани с признаками кровотечения или без них.
Лечение пациенток с апоплексией яичника зависит от формы заболевания и тяжести внутрибрюшного кровотечения. При болевой форме и незначительной внутрибрюшной кровопотере (менее 150 мл) без признаков нарастания кровотечения можно проводить консервативную терапию. Она включает в себя покой, лед на низ живота (способствует спазму сосудов), препараты гемостатического Действия (этамзилат), спазмолитические средства (папаверин, но-шпа), витамины (тиамин, пиридоксин, цианокобаламин), физиотерапевтические процедуры (электрофорез с хлоридом кальция, СВЧ-терапия).
Консервативная терапия проводится в стационаре под круглосуточным наблюдением. При повторном приступе болей, ухудшении общего состояния, нестабильности гемодинамики, увеличении количества крови в брюшной полости клинически и при ультразвуковом сканировании появляются показания к оперативному вмешательству (лапароскопии, лапаротомии).
Показания к лапароскопии:
Показания к лапаротомии:
Прогноз. При болевой форме апоплексии яичника прогноз для жизни благоприятный. У больных с геморрагической формой прогноз для жизни зависит от своевременности диагностики и лечебных мероприятий. К летальному исходу при разрыве яичника может привести декомпенсированный необратимый геморрагический шок, возникающий при кровопотере более 50% ОЦК.
Профилактические мероприятия способствуют снижению частоты рецидивов заболевания.
ГИНЕКОЛОГИЧЕСКИЕ ОСЛОЖНЕНИЯ У ЖЕНЩИН С ПОВЫШЕННОЙ КРОВОТОЧИВОСТЬЮ
GYNECOLOGICAL COMPLICATIONS IN WOMEN
WITH BLEEDING DISORDERS
Р. Пейпер
Общество гемофилии штата Невада, США.
Серия монографий «Лечение гемофилии», №5,
Всемирная федерация гемофилии 1996 в редакции 2000 года
Введение
Проблемы кровоточивости среди женщин зачастую не изучены или не определены. В то время как они весьма распространены, доступная информация по данной проблеме ограничена. В данной статье я предоставляю некоторую, собранную мной информацию для женщин, ищущих ответы на часто встречающиеся вопросы. Большая часть информации, представленной мной и касающаяся диагностики и лечения определенных проблем кровоточивости у женщин, была получена с помощью опросов, проводимых во всем мире в течение последних восьми лет среди женщин, имеющих повышенную кровоточивость.
Упрощенный обзор гемостаза
Сужение кровеносных сосудов (вазоконстрикция)
Это первый шаг в остановке кровотечения, когда кровеносные сосуды сокращаются или сужаются в поврежденной области, стараясь уменьшить приток крови (Рис. 1).
Рис. 2. Формирование тромба
Формирование фибринового сгустка
Проблемы кровоточивости могут быть унаследованы или приобретены в течение жизни женщины. Приобретенная повышенная кровоточивость может быть вызвана некоторыми типами медикаментов, лечения, злокачественными заболеваниями и аутоиммунными нарушениями. Остановимся на наследственных проблемах, которые наиболее часто являются причиной возникновения проблем кровоточивости у женщин.
Болезнь Виллебранда (БВ), как сообщается, является наиболее частой причиной повышенной кровоточивости у людей.
Рис. 4. Наследование болезни Виллебранда
Наличие болезни Виллебранда (БВ) обусловлено геном, переданным от родителей ребенку. Аномальный ген болезни Виллебранда находится на одной из регулярных хромосом, не на хромосоме пола (как гемофилия), и потому БВ встречается с равной интенсивностью, как у мужчин, так и у женщин. Часто точная семейная история может помочь врачу в диагностировании состояния. Иногда аномальный ген может проявить себя впервые в больном, когда никто из родителей им не обладал. Это называется новой «мутацией», и тогда данное заболевание может переходить последовательно детям обычным способом. Специфическое определение гена фактора Виллебранда (ДНК тест) теперь доступно для некоторых форм болезни Виллебранда.
Иногда возможно проследить болезнь Виллебранда в течение нескольких поколений. Рисунок выше демонстрирует обычную модель доминантной наследственности. Хотя генетический дефект унаследован аутосомным способом, это не соответствует классической модели аутосомному доминантному или аутосомному рецессивному типам наследования. Умеренная БВ и некоторые из форм заболевания (тип 2A или 2B) выступают как последствие аутосомной доминантной модели, тяжелая форма БВ, когда фактор Виллебранда, встречается только тогда, когда два гена дефективны.
Точная распространенность не известна, однако, по некоторым оценкам, присутствует у 1% всего населения планеты. БВ встречается во всем мире среди людей всех социально-экономических и этнических групп. Это аутосомное заболевание (то есть, поражает одинаково и мужчин и женщин) (рис. 4). Различают три основных типа БВ в зависимости от того, является ли дефект фактора Виллебранда количественным или качественным. При БВ тип 1, имеется недостаток фактора Виллебранда (фВ). Тип 2 БВ, который имеет четыре подтипа, происходит при качественном дефекте фВ (фактор не функционирует должным образом). При типе 3, фВ почти или полностью отсутствует. Большинство типов унаследовано аутосомным доминантным путем. Тип 3 и 2N наследуются рецессивным путем. Важно знать, какой тип БВ имеет каждый отдельный пациент, потому что лечение различных типов заболевания различно. Если имеется существенное уменьшение фВ, как при типе 3 или проблема с фВ, связанная с фактором VIII как при типе 2N, то существенное уменьшение фактора VIII относительно нормы может также иметь место. Иногда люди с типом БВ 3 или 2N ошибочно диагностированы как больные гемофилией из-за существенно уменьшенного фактора VIII. Чтобы предотвратить такой ошибочный диагноз, необходимо при определении нарушения свертывающей системы крови у пациента проверить уровень факторов VIII и Виллебранда.
Дефицит любого из белков (факторов) свертывания крови может указывать на признаки различной степени серьезности так же, как количественные и качественные дефекты тромбоцитов. Большинство симптомов при таких дефектах будут походить на признаки болезни Виллебранда. Некоторые заболевания, связанные с дефицитом факторов свертывания крови проявляются довольно слабо (например, дефицит фактора XII). Другие, типа гипофибриногенемии (недостаточность фактора свертывания крови фибриногена) особенно проблематичны. Многие данные заболевания наследуются аутосомно женщинами и мужчинами одинаково.
Гинекологические симптомы, наблюдаемые у женщин с повышенной кровоточивостью
Дисменорея и боли в середине цикла
Я беседовала с женщинами, страдающими чрезмерным кровотечением в период овуляции и испытывающими сильную боль в области таза. Когда яйцеклетка выделяется из яичника, у здоровых женщин происходит очень незначительное кровотечение. Но у женщин с нарушением свертываемости крови это может стать значительной проблемой. Однажды я повстречала женщину с болезнью Виллебранда тип 3, у которой кровотечение в период овуляции было столь интенсивным, что ей приходилось принимать противозачаточные средства в виде таблеток, в течение всей жизни, чтобы избежать овуляции.
Многие женщины с проблемами кровоточивости употребляют противозачаточные таблетки или другие средства гормональной терапии. Очевидно, это воздействует на способность женщины к зачатию. Долгосрочный эффект такой длительной гормональной терапии не известен. Также неизвестно, имеет ли дефицит фактора Виллебранда какое-либо влияние на способность оплодотворенной яйцеклетки прикрепляться к стенке матки, что в свою очередь может воздействовать на способность вынашивать плод в течение всего срока. Казуистическим кажется то, что имеется более высокая степень вероятности выкидыша у женщин с БВ, чем в общем случае. Так может происходить просто потому, что когда случается выкидыш, последующее чрезмерное кровотечение заставляет женщину обращаться за медицинской помощью, и при этом отмечается ее диагноз. В то же время выкидыш, случившийся на ранних сроках беременности у обычной женщины, может быть даже не воспринят таковым. Кровотечение, которое следует за самопроизвольным прекращением беременности, может быть весьма значительным, так как высокий уровень факторов свертывания, естественно поддерживающийся в крови во время беременности резко понижается после потери плода.
Послеродовое кровотечение, может стать проблемой для женщин с нарушениями свертываемости. В зависимости от заболевания проблемы могут быть малы или очень незначительны потому, что гормоны, уровень которых повышается во время беременности, вызывают повышение уровня факторов свертывания. Это особенно справедливо в отношении факторов VIII и Виллебранда. Однако даже если никаких сложностей непосредственно после родов не было, несколькими днями позже, когда уровень гормонов и уровень факторов свертывания крови начинает снижаться, может произойти послеродовое кровотечение. У пациенток с болезнью Виллебранда отмечается большее число первичных (немедленных) и вторичных (замедленных) послеродовых кровотечений. У женщин, кормящих грудью, уровень гормонов остается на высоком уровне, однако, неизвестно, защищает ли это от послеродового кровотечения. Беременность не дает никакой защиты женщинам с БВ тип 2, поскольку гормональное повышение и повышения фактора Виллебранда не изменяют функциональное нарушение фВ. Уровень фактора IX не повышается в течение беременности.
Диагностика наследственных заболеваний, вызывающих повышенную кровоточивость
Лечения гинекологических осложнений у женщин с повышенной кровоточивостью
Различные методы лечения, описанные ниже, успешно проявили себя у женщин, с которыми мне удалось побеседовать. Этот список, не является окончательным. Вам следует проконсультироваться с врачом, чтобы определить соответствующий метод в Вашем конкретном случае.
1. Они требуют внутримышечной инъекции, которая не рекомендуема людям с проблемами кровоточивости.
2. Если при введении, у отдельных пациенток возникают побочные эффекты, то они(побочные эффекты) могут продолжаться в течение нескольких месяцев, тогда как период полураспада для оральных контрацептивов намного более краткосрочен.
3. Дозировка может управляться лучше с участием специалиста. Строго говоря, в случае кровотечения, угрожающего жизни, использование внутривенных соединенных эстрагенов (Premarin) весьма эффективно.
Препараты типа аминокапроновой кислоты могут быть полезны при лечении менструального кровотечения, а также кровотечений из слизистой оболочки носа и рта. Эти лекарства не формируют сгусток, они просто сохраняют сгусток на месте дольше, блокируя ферменты, ответственные за фибринолиз (самопроизвольный, нормальный процесс распада сгустка, как только он сформировался). Эти препараты не должны использоваться при суставных и почечных кровотечениях.
НПВС и анальгетики
Большинство НПВС имеют свойство нарушать функции тромбоцитов. Они препятствуют адгезии и агрегации тромбоцитов (тромбоциты становятся неспособными соединяться для формировния сгустка). Данные существуют, чтобы показать, что два противовоспалительных лекарства, choline-magnesium-trisalicylate (Tri-lisate) и salsalate (Disalcid) не изменяют функции тромбоцитов и поэтому могут быть полезными для использования лицами с повышенной кровоточивостью. Эти медикаменты часто полезны для управления болью, связанной с овуляцией и менструацией. Новый класс НПВС Cox-2 ингибиторы (Целебрекс) не вызывают дисфункцию тромбоцитов и могут быть полезны для людей с проблемами кровоточивости.
Женщинам, не поддающимся другому лечению, может потребоваться удаление внутриматочной выстилающей ткани для предотвращения менструации, хотя это и приведет к ее стерильности. Это может послужить безопасной альтернативой гистероэктомии при решении проблем с кровоточивости. Имеются научные данные в литературе, подтверждающие безопасность и эффективность этой процедуры для женщин с рядом проблем кровоточивости.
Для некоторых женщин, являющихся минимально чувствительными или полностью нечувствительными к другим терапиям, гистеротомия может быть единственным приемлемым лечением. Влагалищные или чрезбрюшные гистероэктомии были безопасно выполнены у женщин с проблемами кровотечения после того, как была достигнута адекватная и соответствующая концентрация фактора в плазме крови пациенток.
У женщин, испытывающих боли на фоне эндометриоза (кровотечения из эндометрической ткани, растущей вне полости матки), удаление мигрирующей ткани, используя лапароскопическую методику может быть эффективным. При этой процедуре, делаются два малых разреза в области живота. Специальный зонд для визуально-манипуляционных действий, направляется хирургом через один из разрезов, в то время как ткань удаляется через второй разрез.
Дилятация и выскабливание полости матки
Эти процедуры влекут за собой расслабление и достаточное раскрытие просвета шейки матки и соскабливание эндометрия. Использование данных процедур с намерением уменьшения интенсивности кровотечения не может быть эффективно для женщин с кровоточивостью, поскольку данная методика препятствует тромбообразованию на поврежденных сосудах субэндометриального расположения. Также если дилятация и выскабливание полости матки производятся не в диагностических целях это неприемлемо в случаях с пациентками с повышенной кровоточивостью.
Овариэктомия (удаление яичников) может быть приемлемым вариантом для женщин, страдающих кровотечениями при овуляции, к которым по тем или иным причинам не может быть применена гормональная терапия. Однако, эта процедура не только делает женщину стерильной, но также стимулирует менопаузу.
Обязательно, чтобы женщины, рассматривающие любой из этих вариантов, полностью поняли риски, выгоды и альтернативы прежде, чем принять определенное решение.
Я надеюсь, что эта статья будет полезной для женщин и практикующих врачей, ищущих ответы на некоторые вопросы, встающие перед пациентками с проблемами повышенной кровоточивости. Я также надеюсь, статья поднимет много вопросов, на которое медицинское и научное сообщества будут пытаться найти ответы. Настало время объединить усилия по решению этих проблем.
1. «Females Bleed Too.» HANDI Quarterly (Fall 1993).
2. «Symptomatic Carriers.» HANDI Quarterly (Fall 1994).
3. Medical and Scientific Advisory Council «Recommendations Regarding Women With Bleeding Disorders.» Medical Advisory #303 (1997), National Hemophilia Foundation.
4. Medical and Scientific Advisory Council «Treatment of von Willebrand Disease.» Medical Advisory #314 (1998), National Hemophilia Foundation
5. Bottini, E., et al. «Prevention of Hemoperitoneum during Ovulation by Oral Contraceptives in Women with Type III von Willebrand Disease and Afibrinogenemia. Case Reports.» Haemoatologica 76 (1991): 431-33.
6. Brenner, PF, Ed., «Management of Bleeding Disorders in Women, The Role of the Obstetrician/Gynecologist.» American Journal of Obstetrics and Gynecology. (1996): Suppl. 175(3) Part 2. 761-792.
7. Bunschoten, E. P., et al. «Bleeding Symptoms in Carriers of Hemophilia A and B.» Thrombosis and Hemostasis (Germany) 59, no. 3 (1988): 349-352.
8. Caldwell, David, et. al. «Hereditary Coagulopothies in Pregnancy.» Clinical Obstetrics and Gynecology 28, no. 1 (March 1985).
9. Conti, M., et al. «Pregnancy in Women with Different Types of von Willebrand Disease.» Obstetrics and Gynecology 68 (1986): 282.
10. Cohen, S., et al. «Epidural Analgesia for Labor and Delivery in a Patient with von Willebrand Disease.» Regional Anesthesia 14 (1989): 95-97.
11. Ewenstein, B. «von Willebrand’s Disease.» Annual Reviews in Medicine 48 (1997): 525-42
12. Kouides, P «Females with von Willebrand disease: 72 years as the silent majority.» Haemophilia 4 (1998): 665-676
13. Lee, C.A. «Women and von Willebrand disease.» Haemophilia 5 (1999): Suppl. 2. 38-45
14. Murray E. and Lilicrap, D. «von Willebrand Disease: Pathogenesis, Classification, and Management.» Transfusion Medicine Reviews Vol. X, no 2 (1996): 93-110
15. Paper, R., Baker J and Larson K. «Women Can Have Bleeding Disorders.» Slide presentation. National Hemophilia Foundation. 1999
16. Robertson, L. E., et al. «Hereditary Factor VII Deficiency in Pregnancy: Peripartum Treatment with Factor VII Concentrate.» American Journal of Hematology 40 (1992): 38-41.
17. Scott, J. P., and R. Montgomery. «Therapy of von Willebrand Disease.» Seminars in Thrombosis and Hemostasis 19, no. 1 (1993).
18. Vosburgh, E. «Rational Intervention in von Willebrand Disease.» Hospital Practice (March 1993).