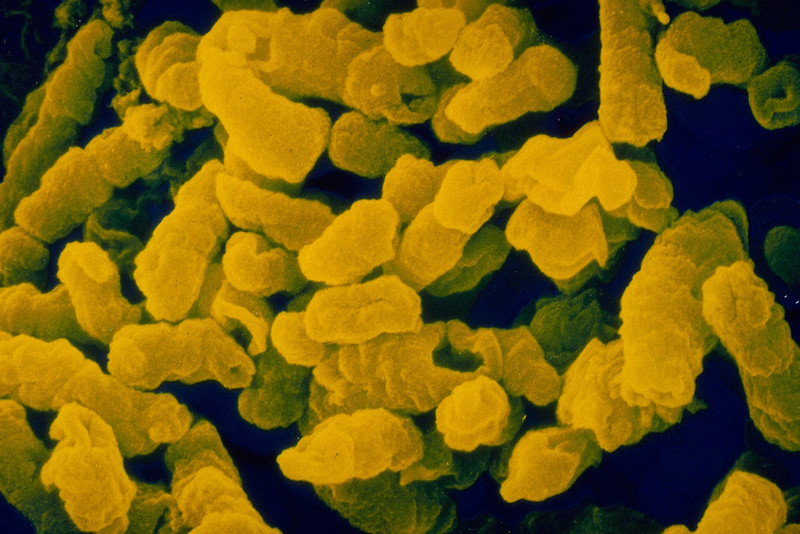
Гемофильная палочка в мазке у мужчин что это
Haemophilus influenzae
Автор: Трубачева Е.С., врач – клинический фармаколог
Сегодняшняя тема касается очередного представителя нормальной микрофлоры, который в определенных условиях способен вызывать тяжелейшие заболевания, как в детском, так и во взрослом возрасте. Речь пойдет о Haemophilus influenzae, проще говоря, о гемофиле.
Начнем традиционно с микробиологических аспектов
Откуда взялось название микроорганизма? Дело в том, что этим маленьким бактериям необходимы факторы, присутствующие в крови (факторы X — гемин и V — никотинамид-аденин-динуклеотид) для роста на шоколадном агаре, поэтому они называются гемоглобинофильными бактериями или гемофилами.
H.influenzae является грамм-отрицательной коккоподобной бактерией, колонизирующей верхние дыхательные пути. Выделяют шесть типов гемофил, обозначаемых буквами от a до f, которые различаются по наличию или отсутствию наружной капсулы. У H.influenzae типа b (Hib) капсула имеется и представляет собой полимерную структуру, состоящую из рибозы и рибитола, скрепленных фосфорной кислотой. Эта капсула является основным фактором патогенности, так как благодаря ей микроорганизм способен эффективно обороняться от фагоцитоза и активации системы комплемента, тем самым обеспечивая свою выживаемость. Поэтому H.influenzae типа b являются самыми инвазивными из всех типов гемофил.
H.influenzae способны к образованию биопленок, которые способствуют выживанию целых колоний, а не только отдельных микроорганизмов, так как еще активнее противодействуют факторам иммунитета. О том, что такое биопленки, мы рассказывали здесь.
При всем вышеописанном гемофилы, в том числе и типа b, являются компонентами нормальной микрофлоры носоглотки. После рождения носоглотка колонизируется бескапсульными H.influenzae, и далеко не всегда эта колонизация ведет к развитию заболеваний. Затем при встрече с носителем Hib подселяются еще и они. Дальнейшее развитие событий будет зависеть от состояния слизистой носоглотки.
Эпидемиологические аспекты
H.influenzae крайне нестойки во внешней среде, любой дезинфектант убивает их мгновенно, поэтому источником заболеваний является только человек — больной или носитель, а механизм передачи исключительно воздушно-капельный, так как возбудители в больших количествах концентрируются в секретах верхних дыхательных путей. И если больных не изолировать (или как минимум не надеть на них маску), то довольно быстро перезаражаются все вокруг.
Особенно много возбудителей скапливается в слюне и слизистом отделяемом больных детей, что указывает на острую их заразность (ничего не напоминает?). А учитывая моду последних лет приводить больных детей (ну подумаешь, сопли и кашляет) в организованные коллективы и отсутствие обязательной Hib-вакцинации, можно получить массовую вспышку в детском саду. Литературные источники говорят о том, что в России до 40% менингитов у детей в возрасте до 5 лет вызваны Hib при летальности в районе 5–10% и тяжелых осложнениях в пределах 40%. При этом носительство H.influenzae типа b среди детей разного возраста для России составляет 35–78%. Помимо этого на первом году жизни могут выделяться нетипируемые штаммы гемофил, способствующие высокому риску развития острого среднего отита. И так как, по понятным причинам, мы не можем рекомендовать расформирование детсадовских групп для уменьшения частоты носительства гемофил, то остается только один выход – вакцинация, которая у нас до сих пор необязательна, а при наличии Hib-компонента в вакцинах, он порой вводится только под нажимом родителей, так как медсестра о его наличии в коробочке может просто не догадываться (этот вопрос очень ярко обсудил в своем блоге врач – педиатр Сергей Бутрий, и не смотря на то, что пост написан для родителей, врачам тоже не мешает помнить, что их назначения могут быть прочитаны, мягко говоря, неоднозначно). И не пора ли энергию, затрачиваемую на борьбу с золотистым стафилококком в носах и кале детей, переключить на выявление и санацию гемофил типа b в этом же возрасте? И дело полезное будет сделано, и от неповинного стафилококка отстанем.
Отдельно стоит отметить, что в странах с преобладающим чернокожим населением (мы уже даже представить не можем, где нас еще могут читать) предрасположенность к носительству и развитию заболеваний, вызванных H.influenzae, а также к смертности детей от гемофильного менингита, еще выше ввиду вероятной генетической предрасположенности.
Клинические аспекты
Все заболевания, вызванные H.influenzae, можно разделить на инвазивные и неинвазивные. Инвазивные заболевания вызываются капсульными H.influenzae типа b, и к ним относятся пневмонии, менингиты, сепсисы, артриты, эпиглотиты и целлюлиты. Важно запомнить, что сдерживающим фактором для капсульных H.influenzae является наличие слизи на поверхности дыхательных путей, и как только она, по каким либо причинам, исчезает, гемофилы тут же закрепляются на эпителии, а так как они не подвергаются процессу фагоцитоза из-за наличия капсулы, то довольно быстро проникают под эпителий, минуют лимфоидный барьер и попадают в кровь, вызывая вышеперечисленные заболевания.
Неинвазивные заболевания, вызванные H.influenzae, возникают как следствие распространения по слизистым оболочкам дыхательных путей нетипируемых бескапсульных гемофил и являются осложнениями ОРВИ, которые смогли понизить местный иммунный ответ. Внимание педиатрам – не стафилококк, с которым некоторые отчаянно воюют, а гемофила вызывает вторичные бактериальные осложнения, если они вдруг возникают.
Когда мы должны подумать о H.influenzae?
Наиболее предрасположены к развитию гемофильных инфекций:
— то есть это будут больные, у которых изначально имеются состояния, способствующие ослаблению иммунной системы, в том числе локальных ее ответов (н-р, нарушение мукоциллиарного клиренса у курильщиков), ведущих к раскрытию входных ворот для гемофил.
После перенесенной гемофильной инфекции, вызванной Hib, формируется очень стойкий иммунитет с высоким содержанием антител. При этом дети до двух месяцев редко болеют, так как в этот момент имеют материнские антитела.
Гемофильные менингиты в возрасте до 5 лет в 90% случаев вызваны H.influenzae типа b, при этом 60% случаев приходится на возраст до 2 лет, и протекают в виде сепсиса с поражением не только мозговых оболочек, но и суставов, среднего уха, легких и т. д.
Вторым крайне грозным детским гемофильным заболеванием, которое в течение нескольких часов может привести к летальному исходу, является острый эпиглотит, он же «круп», способный вызвать полную обструкцию дыхательных путей. Причиной оного так же является H.influenzae типа b.
Острый средний отит, как у детей, так и у взрослых, в большинстве случаев также вызывается H.influenzae — в основном, нетипируемыми штаммами.
У часто болеющих острыми респираторными заболеваниями детей причиной вторичных бактериальных осложнений чаще всего выступает бескапсульная H.influenzae.
Кроме того, не стоит забывать и о внутрибольничном инфицировании и развитии гемофильных вентилятор-ассоциированных пневмоний у пациентов, имеющих свои колонии в носоглотке, либо заражение путем немытых рук и носов сотрудников реанимационной бригады. В этом случае разовьется ранняя (в пределах 2 – 4 суток) вентилятор-ассоциированная пневмония.
Диагностические аспекты
Микробиологическая диагностика играет основную роль в терапии заболеваний, вызванных H.influenzae. Какими методами и средствами мы можем воспользоваться?
Чем лечить?
Главную роль в лечении играют возраст пациента и локализация процесса. Кроме того, необходимо помнить о том, что гемофилы, как и пневмококки, умеют вырабатывать пенициллиназы, чем почти полностью исключают из использования незащищенные формы природных и синтетических пенициллинов, если пациент использовал оные в течение ближайшего полугодия.
Неопасные для жизни инфекции у взрослых, такие как острый средний отит, обострение хронического бронхита или синусит можно лечить по следующим схемам:
Длительность лечения составляет:
Менингиты у взрослых (только антибактериальная терапия)
Менингиты у детей (схемы для недоношенных смотрим в соответствующей литературе, либо в инструкции к использованию упомянутых препаратов)
Тяжелые жизнеугрожающие инфекции у взрослых, такие как пневмония, тяжелый целлюлит, септический артрит:
В заключение нашего разговора хотелось бы еще раз отметить, что основой профилактики тяжелых и жизнеугрожающих гемофильных инфекций первых лет жизни является использование H.influenzae тип b — вакцин и введение оных в национальный календарь прививок, а пока этого нет — проведение разъяснительной работы с родителями (вместо запугивания страшным золотистым стафилококком).
Haemophilus (гемофилюс )
Гемофилюс (Haemophilus) — род грамотрицательных бактерий. Haemophilus имеют вид небольших палочек и неподвижны. Многие Haemophilus являются комменсалами в человеческом организме.
Haemophilus обнаруживается в желудке здоровых людей (при условии отсутствия в нём в доминирующем количестве Helicobacter pylori) (Engstrand L., 2012).
Бактерии Haemophilus — возбудители заболеваний человека
 |
| Мягкий шанкр. Возбудитель Haemophilus ducreyi |
Некоторые виды Haemophilus вызывают серьёзные заболевания человека. В частности, Haemophilus influenzae, называемая также гемофильной палочкой или палочкой Пфейфера (или Пфайфера), является возбудителем так называемых гемофильных инфекций человека, включая гнойный менингит, острую пневмонию, септицимию, воспаления надгортанника, гнойный артит, перикардит, синуситы, отиты и другие заболевания дыхательных путей.
Haemophilus ducreyi является возбудителем венерического заболевания — мягкого шанкра.
 |
| Мозг при менингите, вызванном Haemophilus influenzae |
В редких случаях Haemophilus parainfluenzae, входящий в состав нормальной микрофлоры человека, может вызывать оппортунистические инфекции, в частности, эндокардиты у детей.
Haemophilus aegyptius (палочка Коха-Уикса) — возбудитель бразильской пурпурной лихорадки (код по МКБ-10 A48.4), конъюктивита у детей до 10 лет, без лечения развивающуюся в опасное системное заболевание.
Haemophilus spp. выделяются при синдроме раздражённого кишечника (СРК) с диареей, эзофагите, пищеводе Барретта, бронхиальной астме; Haemophilus influenzae – при пневмонии, синуситах, менингитах, отитах, артритах (Капреева Ю.С. и др.).
Группа HACEK
Haemophilus в систематике бактерий
Род Haemophilus входит в семейство Pasteurellaceae, порядок Pasteurellales, класс гамма-протеобактерии (лат. γ proteobacteria), тип протеобактерии (лат. Proteobacteria), царство Бактерии.
В род Haemophilus входят следующие виды: Haemophilus aegyptius (палочка Коха-Уикса), [Haemophilus] ducreyi (палочка Дюкрея), Haemophilus haemoglobinophilus, Haemophilus haemolyticus, Haemophilus influenzae (палочка Пфейфера), Haemophilus influenzae-murium, Haemophilus massiliensis, Haemophilus paracuniculus, Haemophilus parahaemolyticus, Haemophilus parainfluenzae, Haemophilus paraphrohaemolyticus, [Haemophilus] parasuis, Haemophilus pittmaniae, Haemophilus quentini, Haemophilus simiae, Haemophilus sputorum, Haemophilus taxon C, Haemophilus genomosp. P1.
В составе вида Haemophilus influenzae выделена в отдельную Haemophilus influenzae biotype aegyptius.
Вакцины и антимикробные средства, активные в отношении Haemophilus
Инструкция фирмы-производителя вакцины против Haemophilus influenzae тип b для США на английском языке, pdf: «Hiberix [Haemophilus b Conjugate Vaccine (Tetanus Toxoid Conjugate)]», GlaxoSmithKline.
Шебекинская центральная районная больница
Гемофильная инфекция – достаточно распространенное заболевание в детской возрастной группе. Заболеваемость гемофильной инфекцией высока, однако статистически полноценно вычислить ее сложно. Одной из причин является плохая регистрация, ведь клинически ОРЗ гемофильного происхождения мало отличается от пневмококковой или стафилококковой инфекции. Поэтому могут учитываться только тяжелые случаи с развитием пневмонии, менингита и других проявлений.
Возможность здорового носительства при гемофильной инфекции вызывает опасения, так как является неконтролируемым с эпидемиологической точки зрения процессом. В ряде стран частота носительства в детских дошкольных коллективах достигает 40%, что объясняет высокую заболеваемость ОРЗ в детских садах. Однако наличие специфической профилактики спасает данную ситуацию вплоть до снижения заболеваемости в виде единичных случаев в ряде Европейских стран.
Возбудитель гемофильной инфекции
Возбудитель – гемофильная палочка Афанасьева-Пфейффера (Haemophilus influenzae) типа В (отсюда и название ХИБ). В настоящее время выделяют около 16 видов гемофильной палочки и 6 антигенно различных типов (от a до f), однако наиболее патогенной для человека является именно тип В. Это микроорганизм очень мелких размеров (диаметр до 1 мкм), способный образовывать защитную полисахаридную капсулу. Именно эта капсула позволяет гемофильной палочке длительно выживать в организме человека, уклоняясь от иммунной системы, а также от действия антибактериальных препаратов. «Благодаря» капсуле в организме ребенка длительно не могут вырабатываться защитные антитела или вырабатываются в небольшом количестве, поэтому детки могут заболевать этой инфекцией многократно. Гемофильная палочка – это условно-патогенный микроорганизм, часто является представителем нормальной микрофлоры слизистой дыхательных путей человека, поэтому высока частота здорового носительства данного возбудителя.
Гемофильная палочка после окраски по Грамму
Причины распространения гемофильной инфекции
Источником инфекции является больной клинически выраженной формой заболевания (от ОРЗ до воспаления легких, менингитов и сепсиса). Также источником инфекции являются здоровые носители гемофильной палочки. В очаге гемофильной инфекции частота носительства может достигать 70% у детей и 30-40% взрослых.
Механизм заражения – аэрогенный, а путь – воздушно-капельный (распространение возбудителя происходит при чихании, кашле, разговоре со слизью бронхиального дерева – мокротой, а также слизью рото- и носоглотки). Наибольшая вероятность инфицирования у лиц, находящихся в непосредственной близости с источником инфекции ( 3 метра и менее). Больной становится заразен с появлением симптомов болезни. Носитель внешне здоров, следовательно, с эпидемиологической стороны наиболее опасен, однако у таких людей выделяют наименее заразные типы гемофильной палочки. Дополнительный путь инфицирования – контактно-бытовой (через предметы обихода – полотенца, посуду, игрушки).
Сезонность при данной инфекции – зима-весна. Восприимчивость к данной инфекции высокая среди детей раннего возраста – с 6 мес до 5-ти лет. До 6 мес в силу «материнской защиты» дети заболевают редко. Старше 5-ти лет и взрослые болеют в единичных случаях.
Группы риска по восприимчивости к гемофильной инфекции:
1) Возрастная группа детей с 6 мес до 5-и лет.
2) Лица преклонного возраста старше 65 лет.
3) Дети, находящиеся на искусственном вскармливании.
4) Иммунодефициты (онкологические заболевания, заболевания крови, ВИЧ-инфекция и др.).
5) Лица после удаления селезенки.
6) Социальный иммунодефицит (хронический алкоголизм, наркомания).
7) Дети из закрытых учреждений (дома ребенка, детские дома).
Путь гемофильной палочки в организме человека.
Входные ворота инфекции – слизистая оболочка носоглотки, где возбудитель может находиться длительное время. Дальнейшее развитие процесса во многом зависит от местной сопротивляемости слизистой (снижение сопротивляемости могут вызвать частые простудные инфекции, переохлаждение, стрессы). При слабой сопротивляемости происходит размножение палочки, ее накопление и проникновение в кровь (бактериемия). А дальше инфекция распространяется по излюбленным органам и тканям (легкие, придаточные пазухи носа, костная система, центральная нервная система, и другие) с возможностью развития сепсиса (множественные гнойные очаги).
Симптомы гемофильной инфекции
Инкубационный период (с момента инфицирования до появления первых симптомов болезни) определить практически невозможно, ведь гемофильная палочка может длительно находиться на слизистой носоглотки, не вызывая никаких изменений (бессимптомное течение) и только при снижении защитных сил начинает размножаться.
Начало инфекции может быть схожим с острым респираторным заболеванием (ОРЗ), затем наступает генерализация процесса (палочка проникает в кровь и разносится по организму) и возникает одна из клинических форм.
Выделяется несколько типичных форм гемофильной инфекции:
1) Гнойный менингит (воспаление мягкой мозговой оболочки)
2) Острая пневмония (воспаление легких)
3) Сепсис, в частности одна из его форм – септицемия (системное заболевание)
4) Целлюлит или панникулит (воспаление подкожной клетчатки)
5) Эпиглоттит (поражение на дгортанника)
6) Острый артрит (поражение суставов)
7) Более редкие формы (отиты, синуситы, перикардиты, поражения дыхательных путей и прочие).
Особенности у детей первого года жизни:
3) Из-за высокой температуры высокая опасность судорожного синдрома.
4) Дети первого года жизни быстрее впадают в бессознательное состояние.
5) Выбухание большого родничка (на макушке ребенка). Чем меньше размер большого родничка, тем быстрее может наступить потеря сознания.
6) Эквивалент рвоты – срыгивания.
Что должно заставить обратиться к врачу? Стойкая высокая температура, головная боль или постоянный плач ребенка, рвота или срыгивания, мышечные подергивания. Не нужно выжидать, срочно вызывайте скорую.
Острая пневмония. Одной из частых причин воспаления легких у детей является гемофильная палочка. Пневмония может быть очаговой или крупозной (с поражением доли легкого или нескольких долей), часто осложняется плевритом (воспаление плевры – оболочки легкого) – до 70% случаев у детей. У пациента высокая температура, слабость, вялость, кашель сначала сухой или малопродуктивный, а затем становится влажным (мокрота гнойная с желтоватым оттенком). Нередко нарушения дыхательной экскурсии, что проявляется одышкой. Течение пневмонии затяжное, трудно поддается лечению, может быть волнообразным.
К врачу заставит обратиться: высокая лихорадка, вялость ребенка, отказ от еды, сонливость, срыгивание, кашель и рвота.
Септицемия – системное заболевание, вызванное проникновением гемофильной палочки в кровь, имеющее различные клинические проявления. Чаще гемофильный сепсис возникает среди детей 6-12 мес. Протекает без возникновения вторичных гнойных очагов, тяжело, даже молниеносно. Высока вероятность развития септического шока и летального исхода.
Характеризуется высокой температурой (до 40°), увеличением селезенки, быстрыми нарушениями гемодинамики (падение АД, увеличение частоты пульса), появляются нарушения микроциркуляции (кровоизлияния на коже туловища, конечностей, лица). Летальность высокая.
Что заставит обратиться к врачу? Высокая температура, вялость ребенка отказ от еды, сонливость, бледность кожных покровов, посинение губ, частое сердцебиение, появление кровоизлияний на коже от мелких до крупных, уменьшение частоты мочеиспусканий. Срочно вызывайте скорую.
Гемофильный орбитальный целлюлит
Эпиглоттит в основном встречается у детей с 2х до 4-5 лет и характеризуется тяжелым течением. На фоне высокой температуры появляются сильнейшие боли в области горла, проблемы с глотанием, нарушения дыхания по причины сужения гортани в области воспаленного надгортанника. У пациента нарушение речи (дисфония), бледность кожных покровов, избыточное слюнотечение, запрокидывание головы.
Если вовремя не оказать помощь, возможна полная закупорка гортани в области воспаления вплоть до потери сознания и летального исхода.
К врачу обратиться при: появлении сильной боли в горле и запрокидывании головы ребенка, одышки на этом фоне, невозможности проглотить глоток воды и произнести слово, высокой температуры.
Острый артрит – редко бывает изолированным. На фоне ОРЗ появляется поражение одного или нескольких суставов конечностей. Иногда артриты осложняются воспалением костной ткани (остеомиелит).
Осложнения гемофильной инфекции
— Отек головного мозга вследствие развития гемофильного менингита с синдромом вклинения миндалин мозжечка в большое затылочное отверстие и летальным исходом.
— Острая дыхательная недостаточность вследствие острой пневмонии.
— Асфиксия (непроходимость дыхательных путей) вследствие эпиглоттита с развитием дыхательной недостаточности и летального исхода.
— Септический шок вследствие септицемии с развитием нарушений гемодинамики, микроциркуляции и летальным исходом.
После перенесенной инфекции формируется стойкий продолжительный иммунитет. Повторные заболевания возможны только у иммуноскомпроментированных лиц.
Профилактика гемофильной инфекции
Низкая эффективность антибиотиков против гемофильной палочки привела к необходимости создать другие методы воздействия на микроорганизм. Оптимальной защитой на сегодня считается своевременная вакцинация против инфекции.
Поэтому в странах Запада вакцинация внесена в Национальный календарь прививок уже более 25 лет. В России с 2011 года у родителей появилась возможность защитить своих детей, прививку от гемофильной инфекции делают бесплатно в детской поликлинике.
Иммунопрофилактику проводят не всем детям. Приоритет отдаётся малышам с трёх месяцев и до пяти лет. Это самый опасный период в жизни ребёнка, когда гемофильная палочка может привести к развитию наиболее опасных инфекций.
Вакцинация обеспечивает практически 100% защиту от развития гемофильной инфекции.
Негонококковые уретриты у мужчин: этиология и обоснование этиотропной терапии
Термин «негонококковые уретриты» (НГУ) впервые был предложен в 1954 г. для обозначения случаев воспаления уретрального канала, вызванного иной, чем гонококк, инфекцией. До этого происхождение всякого уретрита считали гонококковым, а случаи отсутствия в м
Термин «негонококковые уретриты» (НГУ) впервые был предложен в 1954 г. для обозначения случаев воспаления уретрального канала, вызванного иной, чем гонококк, инфекцией. До этого происхождение всякого уретрита считали гонококковым, а случаи отсутствия в материале из уретры гонококка объясняли диагностическими трудностями.
Статистические данные свидетельствуют о том, что НГУ является широко распространенным заболеванием, как в Российской Федерации, так и за рубежом. Если в 1996 г. в США частота выявления НГУ составила 2 млн случаев за год (S. O. Aral и соавт., 1999), то к 2000 г. она уже выросла до 3 млн случаев за год (CDC, 2000). В мире, по суммарной оценке, регистрируют около 50 млн случаев НГУ в год (S. O. Aral и соавт., 1999). Только по официальным данным, НГУ в России ежегодно заболевают около 350 тыс. человек, однако эти цифры явно занижены из-за недостаточной регистрации инфекций, вызывающих НГУ.
Этиологические факторы НГУ
Негонококковые уретриты у мужчин могут быть вызваны самыми разнообразными возбудителями, включая облигатные патогены, такие как Chlamydia (C.) trachomatis или Mycoplasma (M.) genitalium, и условно-патогенные микроорганизмы, например другие микоплазмы, в частности Ureaplasma (U.) urealyticum. Причиной НГУ могут быть также вирусы и простейшие.
Роль хламидий в возникновении НГУ. В 70–80-е гг. прошлого века считалось, что около 50% и более случаев НГУ вызваны хламидийной инфекцией. Исследования последующих десятилетий продемонстрировали существенное снижение частоты уретритов у мужчин, вызванных C. trachomatis, — до 20% и менее (M. Shahmanesh, 2001; М. А. Гомберг и соавт., 2002; C. S. Bradshaw и соавт., 2006). В то же время в течение последних лет в Российской Федерации заболеваемость урогенитальной хламидийной инфекцией вышла на первое место среди всех бактериальных инфекций, передаваемых половым путем (ИППП). В нашей стране, начиная с 2004 г., это вторая по распространенности регистрируемая ИППП после трихомониаза.
Уретриты, вызванные С. trachomatis, проявляются обычно скудной клинической симптоматикой, но могут сопровождаться, хотя это нетипично, и признаками острого воспаления, сходными с теми, которые характерны для гонореи.
Роль генитальных микоплазм в возникновении НГУ. Установлено, что человек является естественным хозяином 13 видов микоплазм, из которых возможными возбудителями НГУ могут являться M. hominis, M. genitalium и U. urealyticum. Кроме этих видов микоплазм в урогенитальном тракте также обнаруживают M. fermentans, M. primatum, M. pirum, M. spermatophilum, M. penetrans, M. pneumoniae. Их роль и взаимодействие с организмом человека сегодня активно исследуются, но пока их значение в возникновении уретритов у мужчин не вполне ясно. Так, S. Sharma и соавторы (1998), используя полимеразную цепную реакцию (ПЦР) в дополнение к бактериологическому исследованию, выявили M. pneumoniae у мужчин, которые болели рецидивирующим уретритом и предъявляли жалобы на боль в области уретры и предстательной железы.
Вопрос о роли генитальных микоплазм в этиологии НГУ остается нерешенным из-за широкого распространения этих микроорганизмов и их частого выявления у лиц, не имеющих клинической симптоматики. Мнения исследователей по данному вопросу расходятся. Одни авторы склонны относить микоплазмы к облигатным патогенам, вызывающим уретриты, цервициты, простатиты, послеродовые эндометриты, пиелонефриты, бесплодие, различную патологию беременности и плода. Соответственно, по мнению этих авторов, следует добиваться эрадикации микоплазм в случае их выявления. Другие считают, что микоплазмы являются условно-патогенной флорой урогенитального тракта, и лишь при определенных условиях способны вызывать инфекционно-воспалительные заболевания мочеполовых органов. Большинство зарубежных авторов относят все микоплазмы, за исключением M. genitalium, к условно-патогенной флоре. Именно поэтому в МКБ-10 таких заболеваний, как «микоплазмоз», «уреаплазмоз» или «уреаплазменная инфекция», не зарегистрировано. По мнению многих исследователей, из микоплазм без всяких оговорок к числу патогенов, способных вызывать уретриты, можно отнести только M. genitalium. Однако опыты на экспериментальных моделях, эксперименты по аутоинокуляции культуры U. urealyticum, а также изучение иммунного ответа макроорганизма доказывают участие этих прокариотов в возникновении НГУ. Статистические исследования установили достоверную корреляцию между наличием в мазках из уретры уреаплазмы и хроническими НГУ, в то же время не выявлено достоверной взаимосвязи U. urealyticum c острыми НГУ (P. Horner, 2001). Также не доказана роль U. parvum в возникновении уретритов.
Показатели инфицированности урогенитального тракта микоплазмами весьма разноречивы и среди сексуально активного населения варьируют от 10 до 50%. У больных с НГУ U. urealyticum выделяют в 20–34% и выше (В. И. Кисина, 2002). Уреаплазмы, как правило, обнаруживают у людей, ведущих активную половую жизнь, а наиболее часто эти микроорганизмы выявляют у лиц, имеющих трех и более половых партнеров. Обобщенные данные об эпидемиологии M. genitalium были представлены David Taylor-Robinson (2001) на основе анализа работ 19 наиболее авторитетных исследователей, согласно которым эти микроорганизмы выделяли в 10–50% среди больных НГУ и у 0–17,7% здоровых лиц. Позже N. Dupin и соавторами (2003) было показано, что исчезновение этих микроорганизмов из уретры сопровождается разрешением уретрита, и наоборот — рецидив заболевания может быть связан с использованием препаратов, недостаточно активных в отношении M. genitalium.
Клиническая картина уретрита, при котором обнаруживаются микоплазмы, так же как при инфицировании хламидиями, не имеет патогномоничных симптомов. M. genitalium чаще обнаруживают у лиц с хроническими уретритами, вероятной причиной рецидивирования которых она является. L. Mena и соавторы (2002) показали, что пациенты с M. Genitalium-ассоциированными уретритами в меньшей степени, чем больные с гонококковыми уретритами, предъявляют жалобы на дизурию и выделения, а выделения у них гораздо реже носят гнойный характер.
Как и в большинстве случаев выявления условно-патогенной флоры, для микоплазм выделяют ряд факторов, способствующих развитию инфекционно-воспалительных процессов. Наиболее важными из них являются иммунные нарушения, изменения гормонального статуса, массивность колонизации, ассоциации с другими бактериями. Все эти факторы следует учитывать при выборе тактики ведения таких больных.
Роль аэробной и анаэробной сапрофитной флоры в возникновении НГУ. Роль различной сапрофитной флоры при НГУ весьма спорна. С одной стороны, очевидно, что часто высокие уровни колонизации этими бактериями урогенитального тракта обнаруживаются у мужчин с уретритом, но, с другой стороны, нередко такие же высокие показатели колонизации выявляются у мужчин без признаков воспаления. Можно предположить, что в ряде случаев отдельные представители условно-патогенной флоры или их ассоциации благодаря определенным условиям способны стать возбудителями уретрита, а в иных ситуациях они могут поддерживать воспаление, инициированное другими факторами.
Исследования пациентов с НГУ показали, что это заболевание может быть проявлением мочевой инфекции верхних отделов мочевыводящих путей, основную роль в которой играют грамотрицательные микробные агенты — Pseudomonas aeruginosa, Proteus spp., Escherichia coli и др.
(I. Schugt и соавт., 2004). Имеются также сведения об определенном значении грамположительной флоры — Staphilococcus spp., Corinebacterium spp. В таких случаях, когда роль этой флоры в возникновении НГУ вероятна, при выборе адекватной терапии необходимо определять чувствительность этих микроорганизмов к антимикробным препаратам (W. W. Li и соавт., 2003). Исследования, проведенные в начале 90-х гг. прошлого века (J. C. Lefevre и соавт., 1991), указывают на частое выявление у пациентов с уретритами Haemophilus spp., Gardnerella vaginalis, стрептококков группы В и Escherichia coli.
Возбудители кишечных инфекций привлекают к себе внимание как агенты, способные вызвать НГУ, в связи с возможностью передачи этих микроорганизмов при орогенитальных и аногенитальных контактах. На потенциальную способность энтеробактерий вызывать инфицирование уретры указывали Ю. К. Скрипкин и соавторы (1999). Как показал в своей работе В. П. Ковалык (2006), нередко НГУ, вызванные условно-патогенной флорой, являются следствием незащищенных орогенитальных и аногенитальных контактов.
При уретритах выявляются различные виды негонококковых нейссерий, причем в 85% случаев это Neisseria (N.) meningitidis (М. Maini и соавт., 1992). Вероятными путями передачи инфекции в этих случаях моут быть орогенитальный или аногенитальный половые контакты, которые имеются в анамнезе у большинства из этих пациентов. Изредка такие уретриты клинически сильно напоминают гонококковую инфекцию, сопровождаясь гнойными выделениями и значительно выраженной дизурией.
Часто при исследовании уретрального содержимого как у здоровых людей, так и у мужчин с НГУ выявляются анаэробные бактерии. Сведения о роли анаэробов в возникновении уретритов противоречивы. Большинство исследователей не нашли каких-либо свидетельств патогенной роли этих микроорганизмов. В ходе микробиологических исследований, посвященных сравнительному изучению бактериальной флоры уретры у здоровых и больных НГУ, существенных различий в этом вопросе выявлено не было. E. A. Fontaine и соавторы (1986) отмечали лишь, что Bacteroides urealyticus, возможно, причастны к небольшому количеству случаев НГУ вследствие того, что этот вид несколько чаще выявляют у мужчин с НГУ, чем у здоровых лиц.
О роли анаэробов косвенно можно было бы судить по результатам двойных слепых плацебоконтролируемых исследований по применению метронидазола, который активен в отношении этих микроорганизмов. Однако работы P. D. Woolley и соавторов (1990) показали, что применение метронидазола в дополнение к тетрациклину не позволило улучшить эффективность терапии НГУ. В то же время D. A. Hawkins и соавторы (1988), применяя метронидазол, обнаружили, что в тех случаях, когда заболевание было ассоциировано с анаэробными бактериями, положительная динамика отмечалась значительно чаще, чем в группе без анаэробов.
Кроме перечисленных представителей условно-патогенной флоры, этиологическим или ассоциированным агентом при НГУ, согласно данным литературы, оказывались Streptococcus (Str.) pneumoniae, Str. viridans, Str. mitis, Str. sanguis, Str. аnginosus, Str. agalactiae, Enterococcus faecium, N. subflava, N. perflava и N. flava, Staphilococcus (S.) aureus, S. epidermidis, Corynebacterium pseudodiphtheriae, бактерии, входящие в роды Enterobacter (Spp.), Proteus (Spp.), Branhamella (Spp.), Moraxella (Spp.), Pseudomonas (Spp.) и др.
Роль простейших в возникновении НГУ. Практически единственным представителем этой группы микроорганизмов, который может являться возбудителем уретрита, являются Trichomonas (T.) vaginalis. Они впервые были описаны Alfred Donne в 1837 г., задолго до открытия других ныне известных ИППП. Длительное время T. vaginalis рассматривали как урогенитальный патоген, вызывающий воспалительные заболевания женской половой сферы. В настоящее время доля этих простейших в этиологическом спектре НГУ у мужчин составляет, по некоторым сообщениям, до 17%. В то же время при обследовании мужчин, сексуальных партнеров инфицированных T. vaginalis женщин, трихомонады выделяли лишь в 14–60% случаев (J. N. Krieger и соавт., 1995). Трихомонадная инфекция у мужчин часто протекает бессимптомно. В случае наличия симптомов клиническая картина трихомонадной инфекции у мужчин представлена в большинстве случаев острым НГУ, как правило, коротким по продолжительности. Также простейшие выявляли у 15% больных персистирующим уретритом. Трихомонадная инфекция — одна из самых распространенных ИППП в мире: ежегодно ею заболевают около 174 млн человек (ВОЗ, 2001).
Роль вирусов в возникновении НГУ. По современным представлениям, вирус простого герпеса (ВПГ) может быть причиной возникновения уретритов (P. J. Horner, 2001). Работы, проведенные с использованием современных методов диагностики, показали, что герпетические уретриты выявляются в 42,4–46,6% случаев у мужчин, страдающих рецидивирующим генитальным герпесом (Э. С. Балуянц, 1991; Т. Б. Семенова и соавт., 2001). По данным зарубежных исследований, частота обнаружения ВПГ при уретритах колеблется от 6 до 25% (P. D. Sturm и соавт., 2004; A. A. Oni и соавт., 1997). По данным В. П. Ковалыка (2006), у 44,4% больных с НГУ, возникшими после незащищенных орогенитальных контактов, этиологической причиной уретрита является ВПГ.
В. Н. Гребенюком и соавторами (1986) отмечено, что ассоциация ВПГ с грамотрицательными бактериями усиливает патогенность каждого возбудителя и является причиной устойчивости уретритов к лечению.
По данным N. Avgustinaki и соавторов (2004), у большинства пациентов с НГУ, ассоциированными с ВПГ первого и второго типа, в анамнезе нет указаний на эрозивные поражения половых органов, характерных для генитального герпеса.
Многие эксперты рекомендуют проводить исследования на ВПГ в качестве стандартного обследования при наличии синдрома выделений из уретры.
Аденовирусы также выделяли из урогенитального тракта у мужчин. Уретриты, ассоциированные с аденовирусами, чаще всего сопровождаются появлением эрозивно-язвенных поражений гениталий, конъюнктивитом, симптомами «простуды». Кроме того, клинические особенности уретрита включают наличие меатита и симптомов дизурии (C. S. Bradshaw и соавт., 2002). Первые сообщения появились в 1985 г. — при проведении иммунофлуоресцентного исследования авторы находили аденовирусы у 11,47% пациентов (S. Anghelescu и соавт., 1985). Эпидемиологические исследования последних лет указывают на то, что выделение аденовирусов происходит чаще в осенне-зимний период и встречается у 0,33–4% пациентов, обследующихся на ИППП (P. D. Swenson и соавт., 1995; C. S. Bradshaw и соавт., 2006).
В анамнезе у всех больных имелись незащищенные орогенитальные контакты.
Лечение больных с НГУ
Для разработки индивидуального плана лечения важно учитывать такие факторы, как вид возбудителя, давность инфицирования, история предшествовавшего лечения, наличия сопутствующей патогенной и условно-патогенной флоры.
Этиотропное лечение НГУ основывается на применении антибактериальных препаратов различных групп, активных в отношении основных возбудителей НГУ — хламидий и микоплазм. Активность препаратов в отношении любой инфекции определяется минимальной подавляющей концентрацией (МПК) в исследованиях in vitro. Показатели МПК, как правило, коррелируют с результатами клинического излечения. Оптимальными препаратами считаются антибиотики с наименьшей МПК, но следует помнить о важности таких параметров, как биодоступность, способность к созданию высоких внутритканевых и внутриклеточных концентраций, переносимость и комплаентность лечения.
Для выбора схемы адекватной терапии в конкретных случаях рекомендуется лабораторное определение чувствительности выделенных культур к различным антибиотикам. Но это в основном касается выявленной сапрофитной флоры. Так, многие авторы отмечают способность микоплазм быстро приобретать устойчивость к антибактериальным препаратам при их пассировании in vitro. Следовательно, необходимо тестирование свежевыделенных от больных штаммов. Другая сложность состоит в том, что при выявлении хламидий и микоплазм чувствительность к антибиотикам in vitro необязательно коррелирует с положительным эффектом in vivo. Это может быть связано с фармакокинетикой препаратов. Все эти факторы необходимо учитывать при назначении этиотропной терапии, которая во многих случаях может являться частью комбинированной терапии, особенно при смешанных инфекциях.
Европейское руководство по ведению больных с уретритами (2001) содержит рекомендации, согласно которым следует проводить лечение НГУ по базовым и альтернативным схемам.
Из приведенных схем видно, что основными антибиотиками, рекомендованными для лечения НГУ, являются препараты тетрациклинового ряда, макролиды и фторхинолоны.
Специально разработанных официальных отечественных руководств по лечению НГУ пока нет, но существуют рекомендации по лечению отдельных разновидностей НГУ — трихомонадной, хламидийной и микоплазменных инфекций. Если обобщить рекомендации, изложенные в основных отечественных руководствах («Федеральное руководство по использованию лекарственных средств», «Рациональная фармакотерапия заболеваний кожи и инфекций, передаваемых половым путем» (под ред. акад. РАМН, профессора А. А. Кубановой), «Методические материалы по диагностике и лечению наиболее распространенных инфекций, передаваемых половым путем, и заболеваний кожи (протоколы ведения больных), изданных ЦНИКВИ), то можно представить следующие схемы этиотропного лечения НГУ.
Антибиотики тетрациклинового ряда. Основные препараты:
Макролиды. Основные препараты:
Фторхинолоны:
Препараты тетрациклинового ряда являются самыми распространенными лекарственными средствами для этиотропного лечения больных НГУ. Несмотря на то что доксициклин применяется в лечении различной патологии несколько десятилетий, его активность против главных возбудителей НГУ остается высокой (D. Kilic и соавт., 2004).
В период лечения препаратами группы тетрациклинов больным необходимо избегать инсоляции из-за возможности фотосенсибилизации.
Этого побочного действия совершенно лишены антибиотики из группы макролидов. Все упомянутые руководства к препаратам выбора при лечении НГУ относят макролидный антибиотик азитромицин. Этому способствуют уникальные фармакокинетические характеристики азитромицина: продолжительный период полувыведения, высокий уровень всасывания и устойчивость к кислой среде, способность этого антибиотика транспортироваться лейкоцитами к месту воспаления, высокая и продолжительная концентрация в тканях, а также возможность проникновения внутрь клетки. Благодаря тому, что высокая терапевтическая концентрация азитромицина в тканях достигается после однократного приема стандартной дозы антибиотика и сохраняется в местах воспаления не менее 7 сут, с появлением азитромицина впервые возникла возможность эффективного лечения больных хламидийной инфекцией однократным приемом антибиотика внутрь. Сейчас на рынке появилось много дженериков азитромицина (например: азитрокс, хемомицин, зитролид). Оригинальным и наиболее известным препаратом азитромицина является сумамед, который используется в Российской Федерации с начала 90-х гг. прошлого века.
Преимуществами всех современных макролидных антибиотиков перед первым антибиотиком из этой группы эритромицином являются более высокая эффективность, улучшенная фармакокинетика, хорошая переносимость и меньшая кратность приема.
При приеме макролидов могут наблюдаться побочные эффекты со стороны желудочно-кишечного тракта (тошнота, рвота, диарея) и печени (повышение активности трансаминаз, холестаз, желтуха), а также аллергические реакции.
Наиболее благоприятный, по сравнению с другими макролидами, профиль безопасности имеет джозамицин. Частота побочных эффектов при его приеме не превышает 2–4%. Препарат не обладает гепатотоксичностью и почти не изменяет нормальную микрофлору кишечника. Кроме того, этот препарат в Российской Федерации разрешен к применению у беременных. На нашем фармацевтическом рынке джозамицин пока представлен единственным препаратом вильпрафен.
Необходимо обратить внимание, что уреаплазмы устойчивы к линкозаминам, но чувствительны к макролидам и стрептограминам, а остальные микоплазмы могут быть устойчивы к «старым» макролидам (эритромицин, ровамицин, олеандомицин) и стрептограминам, но высоко чувствительны к новейшим макролидам (джозамицин, кларитромицин) и линкозаминам.
Следующую группу препаратов, обладающих высокой активностью против широкого спектра возбудителей НГУ, составляют фторхинолоны. Единственными препаратами этой группы, которые авторы современных руководств рекомендуют для лечения хламидийной инфекции, являются офлоксацин и его усовершенствованный аналог — левофлоксацин. Ограничения в использовании фторхинолонов для лечения хламидийной инфекции связаны с тем, что в сравнении с антибиотиками других вышеперечисленных групп после терапии слишком высок процент рецидивов.
Такие фторхинолоны, как офлоксацин и спарфлоксацин, особенно высокоэффективны при НГУ, вызванных условно-патогенной сапрофитной флорой, так как обычно эта флора чувствительна к этим антибактериальным препаратам. Их «лидирующее положение» обусловлено широтой антибактериального спектра, высокой бактерицидной активностью, отличными фармакокинетическими характеристиками (быстротой всасывания, высокими концентрациями препарата в тканях, клетках, биологических жидкостях), низкой токсичностью. При лечении спарфлоксацином достигается более высокая комплаентность, так как препарат принимают лишь 1 раз в сутки. По данным Ю. Н. Перламутрова и соавторов (2002), спарфлоксацин также высокоэффективен при микоплазменной и уреаплазменной инфекциях.
Как и тетрациклины, фторхинолоны обладают фотосенсибилизирующим эффектом. Кроме того, препараты из группы фторхинолонов противопоказаны больным с нарушением функции печени и почек. Из побочных реакций после приема фторхинолонов могут наблюдаться диспепсические расстройства, тошнота, рвота, головокружение, аллергические реакции, тендиниты.
Для лечения трихомонадных НГУ рекомендован метронидазол — 2 г перорально однократно по 2,0 г в течение 3 дней или по 500 мг 2–3 раза в сутки в течение 5–7 дней. Кроме метронидазола, могут применяться и другие нитроимидазолы:
Эти препараты обладают несколько лучшими фармакокинетическими параметрами, чем метронидазол, что позволяет снижать дозировки и кратность применения. При этом существенных преимуществ перед метронидазолом эти препараты не имеют, поскольку если трихомонады оказываются устойчивыми к метронидазолу, они будут устойчивы и к другим нитроимидазолам.
Лечение, проводимое одновременно у обоих сексуальных партнеров, увеличивает эффективность лечения НГУ.
По данным В. П. Ковалыка (2006), для лечения НГУ, в этиологии которых установлена роль герпетической инфекции, эффективен валацикловир в курсовой дозе 4,0 г (по 2,0 г с интервалом 12 ч). Можно использовать и схемы, предполагающие более длительный прием противовирусных препаратов:
Если у пациента с НГУ, кроме герпетической инфекции, выявляют и бактериальную, то противогерпетическое лечение назначают как дополнение к антибактериальной терапии. В тех же случаях, когда кроме вирусов при уретритах ничего не обнаруживают, рекомендуется назначать только противовирусную терапию.
Несмотря на правильно проведенную антибиотикотерапию острых НГУ, в 20–69% случаев после окончания лечения через 1–2 нед развивается персистирующий или рецидивирующий уретрит (M. Janier и соавт., 1995; P. J. Horner и соавт., 1999; P. J. Horner и соавт., 2001).
Продолжающийся после лечения уретрита воспалительный процесс является одной из наименее изученных клинических проблем в венерологии. Несмотря на значительные усилия, которые предпринимаются для изучения этого явления, его этиология остается неясной.
Лечение больных хроническим или рецидивирующим НГУ
Поздняя обращаемость пациентов с НГУ, распространение самолечения являются причинами хронизации и осложненного течения заболевания. Терапия больных с длительно протекающими НГУ сопряжена со значительными трудностями в плане достижения клинической эффективности.
Единого подхода к лечению хронического уретрита не существует. Важно клинически и лабораторно подтвердить наличие такого уретрита, поскольку доля пациентов с уретральными симптомами, но без уретрита, достаточно высока.
Схема, предлагаемая Европейским руководством по лечению хронического уретрита: эритромицин — 500 мг 4 раза в день на протяжении 2 нед плюс метронидазол — 2 г однократно или по 400 мг 2 раза в день в течение 5 дней.
По данным K. K. Holmes и соавторов (1998), около 2/3 пациентов после прохождения этого курса лечения избавляются от уретрита, а у оставшейся 1/3 развиваются рецидивы или персистирующие уретриты.
Предлагаются также схемы лечения, отличающиеся большей длительностью приема антибиотиков — от 3 до 6 нед. Однако и они могут оказаться эффективными не для всех пациентов. Врачу важно попытаться найти причину неэффективности антибактериальной терапии и рецидивирования или персистенции уретрита.
Так, например, при длительном существовании в организме C. trachomatis могут менять свой типичный жизненный цикл на атипичный, когда происходит приостановка нормального жизненного цикла хламидий. При этом происходит формирование особых взаимоотношений в системе макро- и микроорганизмов, позволяющих этой системе сосуществовать. Такое явление получило название латенции и персистенции. Клинических проявлений при таком течении инфекции может не быть, как и передачи инфекции от одного сексуального партнера другому.
И антибактериальная терапия на этой стадии может не дать эффекта.
Персистенция хламидий требует особого подхода к больному. Применения одних антибиотиков при этой форме инфекции, как правило, недостаточно, поскольку все эффективные в отношении хламидий антибиотики обладают бактериостатическим действием и способны оказывать свое действие только на размножающиеся бактерии. При лечении таких состояний обычно рекомендуют сочетанную терапию антибиотиками и иммунокорректорами.
Наши наблюдения, основанные на лечении более 1000 больных персистирующим хламидиозом, показывают, что наиболее оптимальным в этих случаях является комбинированная терапия, основанная на сочетании антибиотиков и иммунных препаратов. При антибиотикотерапии используют стандартные для осложненной инфекции курсы и дозировки перечисленных выше антибиотиков. Но начинать лечение желательно с курса иммунотерапии. На основании собственных исследований мы предлагаем следующие варианты предшествующей назначению антибиотиков иммунотерапии:
Комбинированная терапия может оказаться эффективной и при рецидивирующих уретритах микоплазменной этиологии. В работе M. M. T. Hadson и соавторов (1998) сообщается о важности иммунологического статуса больного при уреаплазменной инфекции. Использование иммунотропной терапии может быть особенно актуальным при неэффективности хотя бы одного курса противомикробного лечения.
Наши собственные исследования показали, что при выборе иммунотропной терапии особенно высокую эффективность демонстрировал препарат иммуномакс. Этот препарат относится к группе иммуномодуляторов, и показан для коррекции ослабленного иммунитета, лечения и профилактики вирусных и бактериальных инфекций. Схема применения иммуномакса не отличается от способа его применения при рецидивирующей хламидийной инфекции.
Таким образом, адекватная, т. е. основанная на результатах клинико-лабораторных исследований и существующих рекомендациях, антибактериальная терапия позволяет достичь положительного эффекта при НГУ.
М. А. Гомберг, доктор медицинских наук, профессор
А. М. Соловьев, кандидат медицинских наук, доцент
В. П. Ковалык, кандидат медицинских наук
ЦНИКВИ, МГМСУ, Москва