Гастрэктомия с лимфодиссекцией д2 что это
Лимфодиссекцией (или иначе лимфаденэктомией) называется хирургическое удаление лимфатических узлов при злокачественных опухолях. Лимфодиссекция не является самостоятельной операцией, а представляет собой часть хирургического противоопухолевого лечения.
Для чего проводится лимфодиссекция?
Злокачественные опухоли отличает способность образовывать метастазы, выходя за пределы первичного очага и начиная развиваться в других органах и тканях. Раковые клетки отделяются от первичной опухоли и распространяются по организму с током крови и лимфы, поражая в том числе и сами лимфатические узлы – сначала ближайшие.
Поэтому удаление вместе с первичной опухолью лимфатических узлов позволяет приостановить и даже предотвратить развитие метастазов. Результаты исследования удаленных при лимфодиссекции узлов помогают в составлении оптимальной программы дальнейшего лечения. Таким образом лимфодиссекция сочетает в себе непосредственно лечебную и диагностическую функции.
Показания к лимфодиссекции
Необходимость лимфодиссекции зависит от агрессивности конкретного заболевания и степени распространенности опухоли, то есть стадии рака.
Некоторые опухоли почти не метастазируют, поэтому при их лечении лимфодиссекция не применяется. Это, например, базальноклеточный рак. По той же причине в лимфодиссекции обычно нет необходимости на ранних стадиях рака.
Однако, для быстро метастазирующих видов рака лимфодиссекция является обязательной составляющей радикального лечения. При невозможности её проведения опухоль признается неоперабельной. Это касается, например, рака желудка, панкриатической карциномы, немелкоклеточной карциномы легкого.
В случае ряда заболеваний, — например, раке молочной железы, меланоме, плоскоклеточной карциноме кожи, — прежде чем проводить лимфодиссекцию, делают биопсию сторожевого лимфоузла, чтобы определить наличие в нем метастазов.
Сторожевым узлом называется ближайший на пути распространения опухоли лимфоузел. Чтобы обнаружить его, проводят картирование, выделяя пораженные ткани с помощью меченых изотопов или красящего вещества. После обнаружения сторожевой узел удаляется и передается на морфологическое исследование. Если в данном узле не выявлено следов поражения, то лимфодиссекцию не назначают, так как вероятность появления метастазов минимальна. Если же в сторожевом узле обнаружены опухолевые клетки, то без проведения лимфодиссекции прогноз ухудшается.
Гастрэктомия с лимфодиссекцией д2 что это
Вопрос об оптимальном объеме хирургического вмешательства по поводу дистального рака желудка остается открытым. В литературе можно встретить мнение о необходимости выполнения гастрэктомии, в товремя как другая группа авторов рекомендует выполнение субтотальной дистальной резекции желудка. В исследовании, проводимом Итальянской группой по изучению гастроинтестинальных опухолей, разделили 624 больных на две группы с выполнением дистальной субтотальной резекции (320 больных) желудка и гастрэктомии (304 больных). В обеих группах операция дополнялась D2 лимфодиссекцией. Критериями включения в исследование являлись расположение верхнего края опухоли более, чем на 6 см дистальнее кардии, отсутствие интраперитонеальной диссеминации и отдаленных метастазов. Пятилетняя выживаемость составила 65,3% в группе с дистальной субтотальной резекцией желудка и 62,4% в группе с гастрэктомией. Выполнение субтотальной дистальной гастрэктомии с D2 лимфодиссекцией не сопровождалась такими тяжелыми нарушениями питания и качества жизни больных, как после выполнения гастрэктомий.
Наличие метастазов в лимфатических узлах существенно влияет на прогноз течения заболевания. Выполнение лимфодиссекции требует тщательного соблюдения основных принципов процедуры и наличия опыта у хирурга. Удаление только перигастральных лимфатических узлов обозначается термином D1 лимфодиссекция.
D2 лимфодиссекция предполагает дополнительное удаление цепочки лимфатических узлов вдоль чревного ствола, общей печеночной и селезеночной артерий, ворот селезенки. Выполнение D2 лимфодиссекции рекомендовано Японским обществом по изучению рака желудка, Европейским обществом хирургической онкологии, Международной Ассоциацией по изучению рака желудка. Необходимость выполнения D2 лимфодисссекции диктуется необходимостью корректного стадирования рака желудка, потенциальным преимуществом её выполнения у подгруппы больных с оккультными метастазами в удаленных лимфатических узлах.

Рисунок 1. Группы регионарных лимфатических узлов (Japanese classification of gastric carcinoma-2nd Engl.ed.)
Дренирование лимфы происходит по широко развитой сети лимфатических сосудов. Прыжковые метастазы наблюдаются в 20% случаев, именно этот феномен обусловил необходимость удаления лимфатических узлов второго порядка (D2 лимфодиссекция).
Результаты восьми проспективных нерандомизированных клинических испытаний убедительно продемонстрировали улучшение выживаемости у больных, которым выполнялась D2 лимфодиссекция, особенно у пациентов со II и III стадией заболевания. Однако выполнение D2 лимфодиссекции чревато более высокой частотой смертности и заболеваемости, что связано с частыми повреждениями хвоста поджелудочной железы или резекцией её во время выполнения лимфодиссекции в воротах селезенки. В течение последних лет были проведены три клинических рандомизированных испытания с целью выявить эффективность выполнения D2 лимфодиссекции в увеличении выживаемости больных. Голландское исследование проводилось с участием инструкторов из Японии с целью обеспечить четкое выполнение D2 лимфодиссекции. Однако все три исследования указали на повышение послеоперационных осложнений, в то время, как улучшение выживаемости не достигло достоверности. Основными причинами повышения частоты послеоперационных осложнений были панкреатическая фистула и панкреатит являющиеся следствием спленэктомии и резекции хвоста поджелудочной железы. В подгруппе больных с сохранением селезенки и хвоста поджелудочной железы было отмечено значительное снижение частоты развития локальных рецидивов (Голландское исследование) и улучшение 5-летней выживаемости (исследование в Великобритании). Спленэктомия является прогностически неблагоприятным фактором, очевидно вследствие угнетения функции Т-клеток. Поэтому выполнение спленэктомии оправдано при распространенных опухолях верхней трети желудка, большой кривизны и кардии желудка
Операция резекции и гастрэктомии
29 января 1881 года Теодор Бильрот провел первую успешную операцию резекции желудка при локализации рака в его выходном отделе. Последующая и также успешная операция резекции была проведена через несколько месяцев ассистентом Бильрота. Успех заключался и в продолжительности жизни пациента, первого среди прооперированных по поводу рака желудка прожившего пять лет после операции.
Уважаемые пациенты! Обратите внимание на следующие материалы сайта:
Несмотря на то, что с момента выполнения первой успешной операции на желудке прошло более 130 лет и за прошедшее время медицина шагнула далеко вперед, основным методом лечения рака желудка остается операция. Никакие другие методы лечения не могут заменить хирургическое вмешательство.
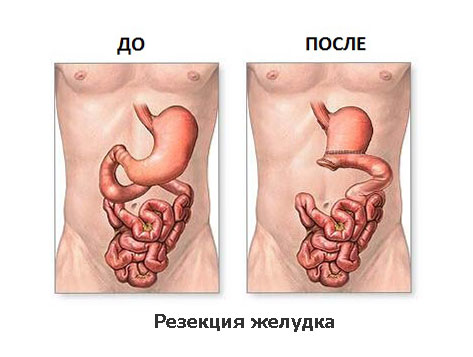
Принципиально выделяют два вида радикальных операций по поводу рака желудка: субтотальная резекция желудка и гастрэктомия. Выбор объема операции зависит в первую очередь от локализации опухоли в желудке, уровня глубины проникновения опухоли в стенку желудка, а также её распространение на соседние органы и структуры.
Дистальная субтотальная резекция желудка
При распространении опухоли на соседние органы выполняется и их резекция. Операция завершается восстановлением непрерывности желудочно-кишечного тракта формированием анастомоза (соустья) между оставшейся частью желудка и тонкой кишкой.
Существует несколько десятков способов восстановления непрерывности желудочно-кишечного тракта, но наиболее часто применяемыми являются следующие: по Бильрот, Бальфуру, Ру, Райхелю—Полиа, Хофмейстеру—Финстереру, Мойнихену. Анастомозы формируются с помощью ручного шва, либо с помощью различных сшивающих аппаратов.
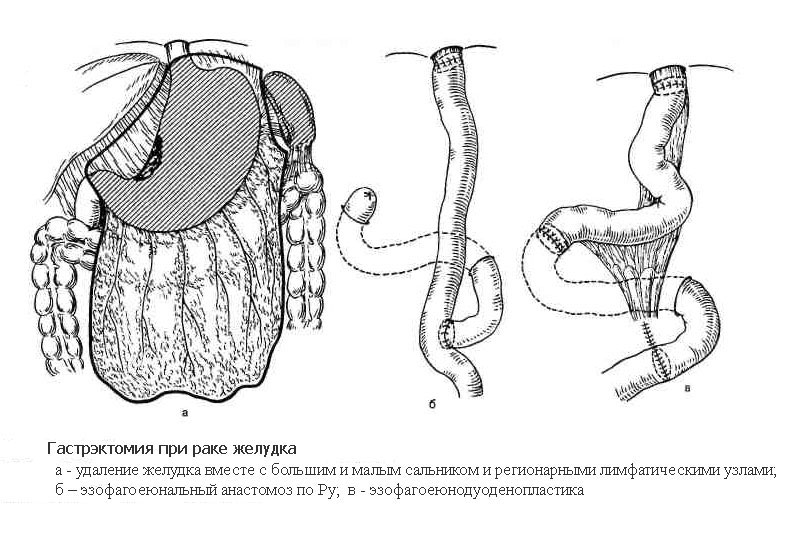
Гастрэктомия
Гастрэктомия – операция, выполняемая при локализации раковой опухоли в средней и верхней трети тела и кардиальном отделе желудка, а также при расположении опухоли в месте перехода желудка в пищевод (кардиоэзофагеальный рак). Объем операции включает удаление всего желудка, также с обязательным выполнением лимфодиссекции. В отдельных случаях дополнительно удаляются селезенка вместе с телом и хвостом поджелудочной железы. При распространении опухоли на соседние органы выполняется и их резекция. Операция завершается формированием анастомоза напрямую между пищеводом и тонкой кишкой, также либо с помощью ручного шва, либо с помощью специальных сшивающих аппаратов.
Изложенные операции могут выполняться традиционным (открытым) методом и с помощью высокотехнологичных малотравматичных методов (лапароскопическим или роботическим).
Традиционный (открытый) метод применяется у пациентов с местнораспространенными опухолями желудка требующие расширенных и комбинированных операций с резекцией соседних органов и структур, а также у пациентов с высоким индексом массы тела (ИМТ>30).
У пациентов с начальной (I-II) стадией заболевания и с ИМТ
Гладышев Дмитрий Владимирович:
Коваленко Сергей Алексеевич:
Городская больница №40, г.Сестрорецк, ул.Борисова, д.9, хирургический корпус (№4), кабинет №19.
Часы приёма: понедельник, среда, пятница с 15.00 до 17.00. По направлению онкологов поликлиник.
Запись по телефону: 8-911-235-21-80.
Информационно-справочная служба: +7 (812) 437-40-75 и +7 (812) 437-31-11
Отдел платных услуг: +7 (812) 437-11-00 и +7 (911) 766-97-70
Информация по отборочной комиссии: +7 (812) 437-09-07
Отдел госпитализации: +7 (812) 437-03-68 и +7 (812) 434-32-13
Запись на МРТ, КТ, ПЭТ КТ : +7 (812) 437-35-13 и +7 (911) 171-06-04
Маммография: +7 (812) 200-16-88.
Вы можете выбрать удобную для Вас дату исследования соответственно с периодом менструального цикла.
Кроме того, Вы можете оставить свой вопрос в рубрике «Вопрос-ответ» и сотрудники отдела платных услуг обязательно свяжутся с Вами или ответят по указанному Вами адресу электронной почты.
Гастрэктомия с лимфодиссекцией д2 что это
Рак желудка является одной из наиболее распространенных злокачественных опухолей человека и одной из наиболее серьезных проблем в онкологии и медицине в целом. Несмотря на глобальное снижение заболеваемости, его частота остается весьма высокой во многих странах, включая Россию. Отдаленные результаты лечения рака желудка, несмотря на несомненный прогресс в хирургии и адъювантной терапии, остаются малоутешительными. Пожалуй, нет темы в современной онкологии вообще и в проблеме рака желудка в частности, которая бы в последние десятилетия привлекала столько внимания, вызывала бы столь яростные споры, как оптимальный объем лимфодиссекции. Теоретически удаление большего количества лимфатических узлов в более отдаленных лимфоколлекторах увеличивает радикальность операции и соответственно дает больший шанс больному на излечение. Однако такие операции могут не принести ожидаемого результата в ситуациях, когда метастазы в лимфатические узлы отсутствуют; если опухоль распространилась за пределы удаляемых групп лимфатических узлов лимфогенно либо по другим путям метастазирования; если вмешательство существенно увеличивает послеоперационную летальность.
Только сейчас, после многих десятилетий дебатов об оптимальном объеме оперативного вмешательства при раке желудка, становится возможным выбирать метод лечения, основываясь на принципах доказательной медицины по результатам проведения качественно спланированных исследований. В соответствии с канонами доказательной медицины наибольшую степень достоверности имеют результаты рандомизированных исследований и их метаанализы. Целью настоящей работы явился критический анализ результатов рандомизированных исследований и метаанализов, посвященных сравнительному изучению различного объема лимфодиссекции при раке желудка.
Материал и методы
Осуществлен поиск в электронных базах данных PubMed, EmBase и Cochran Library с 1999 по 2011 г. по ключевым словам «gastric cancer» or «stomach neoplasms» and «lymphadenectomy» or «D2» or «D3» or «D4» or «para-aortic». Дизайн отобранных исследований был ограничен формами «randomized clinical trails» и «metaanalysis», языком публикации (английский), наличием в статье показателей послеоперационных осложнений, летальности, 5-летней выживаемости, количеством больных более 100 в каждой из групп сравнения. Критериями включения были больные потенциально резектабельным морфологически подтвержденным раком желудка, отсутствие отдаленных метастазов. В результате поиска описанным выше критериям соответствовало 7 рандомизированных исследований (табл. 1) 
Результаты и обсуждение
Dl и D2
Непосредственные результаты обоих исследований оказались весьма сходными. Выполнение лимфодиссекции в объеме D2 по сравнению с D1 сопровождалось значительным ростом послеоперационной летальности (10-13 и 4-6,5%), частоты послеоперационных осложнений (43-46 и 25-28%), прежде всего несостоятельности швов анастомозов (в английском исследовании она достигла 26% в группе D2) и абсцессов брюшной полости, частоты повторных операций (18 и 8%), средней длительности пребывания больных в клинике после операции (23-25 и 18 дней); все различия статистически достоверны (р 0,05). Авторы полагают, что в настоящее время в специализированных центрах на Западе лимфодиссекция D2 может быть выполнена гораздо более безопасно, чем по результатам ранее проведенных рандомизированных исследований. Отдаленные результаты данного исследования к настоящему времени не опубликованы.
D1 и D3
D2 и D4 (D2+PAND)
Непосредственные результаты исследований оказались сходными, количество послеоперационных осложнений в группах сравнения варьировало
в пределах 20-28% и лишь в исследовании Y. Yоnemura и соавт. [8] было достоверно выше в группе D4 (40 и 26%). Расширение объема лимфодиссекции также приводило к статистически значимому увеличению длительности операции и объема кровопотери. Послеоперационная летальность, по сообщениям всех авторов, статистически достоверно не различалась, составив менее 1% в исследовании M. Sasako и соавт. [21]. Очень низкие показатели послеоперационной летальности и осложнений в последнем исследовании авторы объясняют отбором соматически сохранных больных; выполнением операций квалифицированными хирургами и в крупных многопрофильных клиниках, позволяющих осуществлять качественное анестезиологическое и послеоперационное пособие; исключение из стандарта вмешательств резекции поджелудочной железы.
Y. Yonemura и соавт. [9] выявили метастазы в парааортальных лимфатических узлах у 12 (9%) из
134 больных; более 5 лет прожили 3 больных, в том числе 1 с рецидивом опухоли. M. Sasako и соавт. [6] морфологически подтвердили метастазы в парааортальных лимфатических узлах только у 22 (8,5%) из 260 больных; 5-летняя выживаемость у них составила 18,2% (4 больных). При факторном анализе авторы получили неожиданные результаты в отношении влияния метастатически пораженных лимфатических узлов на выживаемость. Так, среди 174 больных без метастазов в лимфатические узлы (pN0) общая 5-летняя выживаемость была выше в группе D4 (96,8%) по сравнению с D2 (78,4%), а среди 348 больных с рN+, наоборот, она была выше в группе D2 (65,2 и 54,9%). В своих комментариях авторы призывают не делать из данного наблюдения далеко идущих выводов, поскольку этот анализ был проведен после завершения исследования и в его цели не входил.
Отдаленные результаты польского исследования до настоящего времени не опубликованы.
В двух японских исследованиях как общая, так и безрецидивная 5-летняя выживаемость в группах D2 и D4 не различалась. В то же время различия между данными, приводимыми M. Sasako и соавт. [6] (5-летняя выживаемость 69-70%) и Y. Yonemura и соавт. [9] (52-55%), весьма значительны и трудно объяснимы, учитывая сходные критерии включения больных и параллельное выполнение исследований. Авторы констатировали, что по сравнению с D2 дополнительная парааортальная лимфодиссекция не увеличивает показателя выживаемости и потому не может быть рекомендована к применению при раке желудка.
Метаанализы
D1 и D2/D3
Пять метаанализов было предпринято для сравнения непосредственных и отдаленных результатов лечения больных раком желудка с использованием лимфодиссекции D1 и D2/D3. Результаты оказались идентичными: при увеличении объема вмешательства достоверно увеличивались частота послеоперационных осложнений (в том числе несостоятельности швов анастомозов, внутрибрюшных абсцессов и инфекционных осложнений со стороны лапаротомной раны, легочных осложнений) и летальность, количество релапаротомий, длительность пребывания больного в стационаре; в то же время выживаемость была одинаковой. Основной причиной увеличения числа осложнений авторы считают выполнение спленэктомии и резекции поджелудочной железы, а также недостаточную подготовку хирургов в «ранних» исследованиях 13. R. Seevaratnam и соавт. [22] в последнем из опубликованных метаанализов (декабрь 2011 г.) показали, что в более поздних исследованиях [4, 5, 7] различий в послеоперационной летальности не было (1,5 и 1,2%; р=0,7). При факторном анализе авторы также выявили тенденцию к увеличению 5-летней выживаемости в группе D2 по сравнению с D1 (р=0,07) при выполнении сплено- и панкреатосохранных операций. Данные о частоте развития рецидивов приведены только в трех исследованиях. При сравнении результатов лечения 690 больных в группе D1 и 642 больных в группе D2/D3 было показано, что в последней группе частота развития рецидивов и метастазов и смертность от них были достоверно ниже (р=0,02-0,04), хотя имелась значительная статистическая гетерогенность данных (р=0,03) [13].
D2 и D4 (D2+PAND)
Общими недостатками европейских рандомизированных исследований были нестандартизованный объем оперативных вмешательств, в том числе избыточные показания к панкреато- и спленэктомии, а также недостаточная профессиональная подготовка хирургов и, как следствие, исключительно высокие показатели послеоперационных осложнений и летальности. Эти данные в очередной раз подтвердили необходимость выполнения операций по поводу рака желудка только в специализированных центрах. C. Wu и соавт. [4] на собственном опыте показали, что количество хирургических осложнений и летальность достоверно снижаются и выходят на плато после выполнения 200 операций D2. Здесь следует отметить, что различия показателей летальности в группах D1 и D2 в европейских исследованиях (6-6,5%) практически полностью соответствуют тому выигрышу в 5-летней выживаемости, который и определил (при отсутствии послеоперационной летальности) успех исследования C. Wu и соавт. [5]. Кроме того, в последние годы появились работы, показывающие, что несостоятельность швов анастомозов и другие воспалительные осложнения в брюшной полости с высокой степенью статистической значимости являются факторами негативного прогноза отдаленных результатов лечения [24].
Частота развития локорегионарного рецидива, в том числе изолированного, во всех исследованиях была весьма значительной, и лишь в последней публикации голландской группы это понятие было разделено на локальную и регионарную составляющие [10]. По данным авторов, частота локального рецидива с высокой степенью статистической значимости была выше в группе D1 по сравнению с D2 (22 и 12%; р=0,001). Авторы никак не комментируют этот странный факт, хотя, по их данным, и состав групп сравнения, и объем операций на желудке, и частота опухолевых клеток по линии резекции (6,6%) существенно не различались. В целом во всех рассматриваемых исследованиях преобладали опухоли дистальной локализации, по поводу которых выполнялись вмешательства в объеме дистальной субтотальной резекции желудка, этот показатель в японских публикациях достигал 75-79%. На наш взгляд, столь высокая частота локальных рецидивов связана именно с завышением показаний к резекциям желудка, их выполнением лишь на основании локализации опухоли без учета других прогностически значимых факторов. Так, нами было показано, что выполнение радикальной (R0) субтотальной резекции по поводу перстневидно-клеточного рака желудка дистальной локализации приводит к развитию локального рецидива у 14% больных.
Что касается частоты развития регионарного рецидива, то практически все авторы отмечают ее снижение при увеличении объема лимфодиссекции, однако в большинстве наблюдений это не сказывается на показателе выживаемости, поскольку регионарный рецидив наиболее часто сочетался с отдаленными метастазами.
Результаты метаанализов оказались вполне прогнозируемыми: были продемонстрированы худшие непосредственные результаты и отсутствие увеличения выживаемости в группе D2 по сравнению с D1 и в группе D4 по сравнению с D2. Учитывая отобранные исследования, полученные результаты настолько очевидны, что столь громоздкий статистический анализ можно было и не проводить. Два европейских исследования, ввиду очень большого количества включенных в них больных, не позволяют более поздним и с более благоприятными результатами исследованиям что-то изменить в полученных результатах. Тем не менее следует отметить выделение «ранних» и «поздних» рандомизированных исследований и доказательство безопасности выполнения лимфодиссекции D2 в ее современном виде (с сохранением селезенки и поджелудочной железы) в специализированных центрах. Выявленная R. Seevaratnam и соавт. [22] тенденция к увеличению 5-летней выживаемости в группе D2 по сравнению с Dl (p=0,07) при выполнении сплено- и панкреатосохранных операций, по нашему мнению, связана в первую очередь с исключением большинства летальных исходов в группе D2. Однако такая трактовка противоречит исходным методологическим построениям каждого из исследований и потому не может быть принята в качестве доказательства. В заключение авторы справедливо отмечают, что так называемые «ранние» и «поздние» исследования весьма существенно различаются в плане хирургического подхода и в дальнейшем их следует анализировать отдельно.
X. Chen и соавт. [15], считающих, что нет смысла проводить подобные исследования в обозримом будущем, поскольку увеличения выживаемости при выполнении парааортальной лимфодиссекции не отмечалось ни в целом по группам, ни при факторном анализе, а реальная частота поражения парааортальных лимфатических узлов при отсутствии органных и перитонеальных метастазов была весьма низкой (менее 10%).
Одним из основных факторов, приводящих к ухудшению непосредственных результатов и препятствующих улучшению отдаленных результатов лечения при увеличении объема лимфодиссекции по данным как отдельных исследований, так и метаанализов, признается выполнение принципиальной спленэктомии и резекции поджелудочной железы. Такой объем вмешательства ранее считался обязательным для полноценного выполнения расширенной лимфодиссекции. Однако опубликованный в 2011 г. метаанализ 40 исследований (4 рандомизированных, 6 проспективных и 30 ретроспективных) убедительно показал, что сохранение селезенки и поджелудочной железы в сочетании с гастрэктомией и D2 способствует уменьшению количества послеоперационных осложнений и не влияет на отдаленные результаты лечения [23]. Необходимо подчеркнуть, что инвазия рака желудка в селезенку и поджелудочную железу, безусловно, требует выполнения мультивисцеральных резекций и не имеет отношения к выбору объема лимфодиссекции.
Накопление клинического материала позволило выделить группы больных, у которых расширенная лимфодиссекция не приводит к улучшению отдаленных результатов лечения в связи с ранним развитием имплантационных метастазов. Прежде всего это больные с низкодифференцированным, перстневидно-клеточным и недифференцированным раком желудка, инфильтративным типом роста и значительным размером опухоли, массивным лимфогенным поражением, наличием свободных опухолевых клеток в брюшной полости. Более того, было показано, что само оперативное вмешательство неизбежно приводит к диссеминации раковых клеток по всем путям метастазирования. F. Miyazono и соавт. [29], используя методы молекулярного анализа, обнаружили после операции опухолевые клетки в крови у 33,3% больных по сравнению с 8,8% до операции (различие статистически значимо), причем частота обнаружения раковых клеток закономерно возрастала с увеличением глубины прорастания опухолью стенки желудка, достигая 100% при рТ4. Наблюдение показало, что рецидив заболевания развивался статистически достоверно чаще у больных, у которых были обнаружены циркулирующие раковые комплексы в крови, превалировали гематогенные метастазы. T. Marutsuka и соавт. [28] изучили причины развития канцероматоза брюшины в ситуациях, когда опухоль не прорастала серозную оболочку. Оказалось, что после выполнения лимфодиссекции частота обнаружения раковых клеток в брюшной полости достигала 46% и именно они являлись субстратом последующего развития перитонеального рецидива.
Таким образом, с учетом приведенных данных, а также собственного клинического опыта мы считаем, что в настоящее время лимфодиссекция D2 в специализированных центрах, в том числе на Западе, может выполняться с низкими показателями послеоперационных осложнений и летальности. Дальнейшее расширение объема лимфодиссекции не приводит к улучшению отдаленных результатов лечения и может применяться только в рамках контролируемых клинических исследований у ограниченной группы больных. Спленэктомия и резекция поджелудочной железы не являются обязательными составляющими оперативного вмешательства при раке желудка и должны выполняться только при наличии соответствующих показаний. Основным объемом вмешательства у больных раком желудка является гастрэктомия, показания к субтотальной резекции должны быть ограничены с целью профилактики развития местного рецидива. Основным методом лечения рака желудка (за исключением ранних стадий) должен быть комбинированный, сочетающий оп