Галектин 3 что это
Неоконченная история галектина-3
Неоконченная история галектина-3
Возможности галектина-3 безграничны?
рисунок автора статьи
Автор
Редакторы
Статья на конкурс «био/мол/текст»: После окончания университета мне больше всего хотелось заниматься разработкой новых лекарств. Несмотря на то, что это сложно. И долго. И дорого. Мне очень повезло: я попала в инновационную компанию «Антерикс» (г. Пущино), и мне поручили работать над поиском антител против галектина-3. Так я познакомилась с этой неординарной биомолекулой, которая, с одной стороны, чрезвычайно важна для жизни каждого из нас, а с другой — способна натворить больших бед.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2016.
Спонсор номинации — Future Biotech, проект, объединяющий профессионалов и энтузиастов в области биологии и биотехнологий.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Что такое галектин-3?
Существование многоклеточных организмов возможно благодаря способности клеток делиться и дифференцироваться — получать «профессию». То есть становиться нервной, мышечной, железистой или любой другой. Непросто содержать в порядке сложную систему из множества клеток. Для этого нужна уйма сигнальных веществ и метаболических путей. Но иногда отлаженный механизм регуляции в клеточном мегаполисе сбивается. Так возникает болезнь.
Например, из-под надзора иммунной системы ускользнула раковая клетка. Она поторопилась поделиться, образовала опухоль и задумалась: а не пора ли попутешествовать? И вот от нее отделились и уплыли по кровотоку несколько клеток. Теперь главная их задача — зацепиться за стенку сосуда, чтобы дать начало метастазу. Часто им в этом помогает белок галектин-3.
Его название говорит о том, что перед нами белок-лектин, который среди всего прочего предпочитает сахар галактозу. Все лектины умеют связывать углеводы, а это открывает им широкие возможности для функционирования. Дело в том, что углеводы в живых организмах выступают не только «топливом» для получения энергии, но и входят в состав воспринимающей части многих рецепторов. Напомню, что рецептор — это молекула-«антенна» на поверхности или внутри клетки. Связавшись с лигандом (сигнальной молекулой), она изменяет свою конфигурацию, тем самым сообщая клетке, что что-то произошло [1].
О том, как с помощью лектинов можно бороться с раком, подробно рассказывается в статье «Лектины — новые инструменты в диагностике и терапии злокачественных опухолей» [2]. — Ред.
Поверхности клеток и кровеносных сосудов выстланы разными углеводными остатками, как густым ковром. Лектины участвуют в клеточном распознавании, могут вызывать агглютинацию (слипание) клеток, влияют на работу иммунной системы [3]. Еще бы! Ведь она распознает не столько сами бактерии, сколько их углеводные оболочки [4].
Галектин-3 — небольшой белок. Его молекулярная масса всего 27 кДа, и он состоит из одной полипептидной цепи [5]. А еще он буквально вездесущ. За двадцать лет, в течение которых он известен ученым, его обнаружили во многих клетках, причем как в ядре, так и в цитоплазме, в сыворотке крови и внеклеточном пространстве множества органов [6].
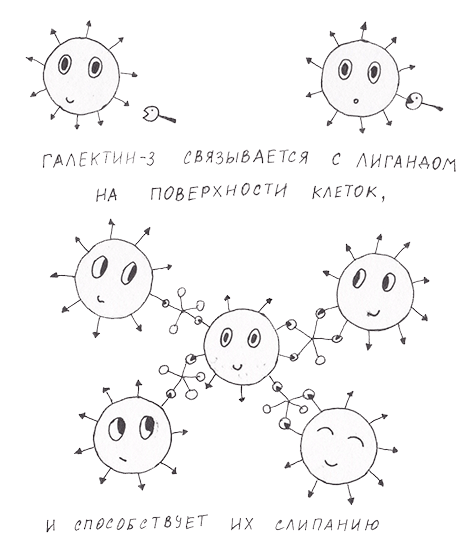
В норме галектин-3 принимает участие в процессах клеточного самоубийства (апоптоза), активации клеток и прилипания их друг к другу (адгезии). Разберемся, как ему это удается. Следует начать с того, что все галектины имеют углеводсвязывающий домен. У разных членов семейства он различается незначительно. Галектины могут состоять из одного такого домена или двух, связанных между собой небольшим линкером [7]. Но галектин-3 отличается от всех прочих тем, что при одном углеводсвязывающем домене он способен мультимеризоваться — объединяться в структуру из пяти углеводсвязывающих доменов [8]. Мультимеризация происходит, если галектин-3 связывается с лигандом. А значит, он может действовать как «клей», объединяющий вместе несколько клеток (рис. 1).
Рисунок 1. Галкетин-3 связывается с лигандом на поверхности клетки, пентамеризуется и вызывает адгезию
рисунок автора статьи
Легче всего найти галектин-3 там, где высока вероятность встречи с инфекцией: в слизистых оболочках и выстилке внутренних органов. Но самое главное — его могут производить клетки, вовлеченные в иммунный ответ. Например, нейтрофилы, которые составляют основную часть всех лейкоцитов крови [9], базофилы и тучные клетки, которые могут запускать аллергическую реакцию [10], дендритные клетки, показывающие антиген другим участникам иммунного ответа, макрофаги, способные съесть и переварить опасные частицы, и многие другие. Все они на редкость непоседливы и хорошо вооружены. Многие из них способны мигрировать за пределы кровеносных сосудов и при встрече с инфекцией выпускать провоспалительные медиаторы и активные формы кислорода [11], которые растворяют все вокруг. И опять здесь не обходится без галектина-3. Он может активировать продукцию супероксид-аниона у моноцитов [12] и повысить фагоцитарную активность нейтрофилов [13].
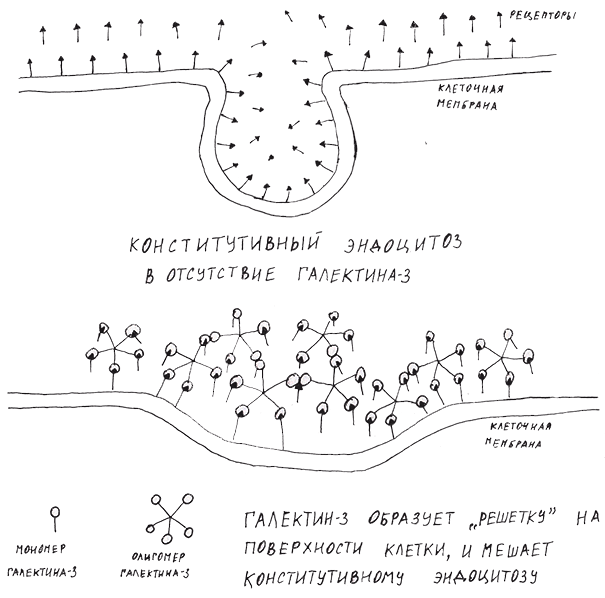
Как же одна маленькая молекула объединяет в себе столько функций? Оказалось, что галектин-3 не столько запускает все эти процессы, сколько повышает восприимчивость клеток к привычным для нее сигналам. Дело в том, что клетка постоянно поглощает части собственной мембраны, захватывая при этом множество рецепторов. Этот процесс называется конститутивным эндоцитозом. Предполагается, что галектин-3, связываясь с гликозилированными молекулами на поверхности клетки, образует «решетку», которая, судя по всему, препятствует конститутивному эндоцитозу (рис. 2). Это объясняет, каким образом присутствие внеклеточного галектина-3 заставляет клетки активироваться [14]. Другими словами, на поверхности клеток остается много рецепторов, и они продолжают воспринимать сигналы от своих лигандов.
Рисунок 2. Галектин-3 препятствует удалению рецепторов с помощью конститутивного эндоцитоза
рисунок автора статьи
Одной из главных функций апоптоза — клеточного «самоубийства» — является уничтожение мутантных, инфицированных или дефектных клеток. Это довольно сложный процесс. Он включает в себя три фазы: сигнальную, эффекторную и деградационную [15]. Впрочем, с точки зрения участия галектина-3 нас интересует только сигнальная фаза. Она начинается с того, что с рецепторами смерти на поверхности клетки связывается специфический лиганд. Это значит, что клетка получила приказ «умри». С этого момента активируется целый каскад реакций, которые приводят к тому, что в клетке повреждаются митохондрии. Напомню, что митохондрии — это клеточные органеллы, которые производят энергию в виде молекул АТФ. Они чрезвычайно важны для жизнедеятельности, поэтому нарушение их работы влечет за собой клеточную гибель.
Нарушают целостность митохондрий специальные белки — Bax и Bak. Они встраиваются в митохондриальную мембрану, олигомеризуются и нарушают ее целостность [16]. Но пока этого не случилось, у клетки еще есть надежда на спасение. Дело в том, что у Bax и Bak есть антагонисты из их собственного семейства: Bcl-2, Bcl-xL и другие. Это — антиапоптотические белки, то есть те, которые не желают клетке смерти. Они имеют характерную особенность — последовательность из четырех аминокислот: аспарагин-триптофан-глицин-аргинин. Галектин-3 имеет точно такую же последовательность. Более того, у них 28% идентичных и 48% сходных аминокислотных остатков в последовательности [17]. И это не случайно. Есть данные, что галектин-3 предотвращает апоптоз не хуже, чем белки семейства Bcl-2. Точный механизм его действия, к сожалению, еще не выяснен, но уже понятно, что в этот процесс вовлечены многие регуляторные пути. В ответ на апоптотические стимулы галектин-3 поступает в пространство между внутренней и внешней мембранами митохондрий и мешает апоптотическим белкам выполнять свои функции [18].
В чем «виноват» галектин-3?
Итак, галектин-3 «склеивает» клетки между собой, вызывает их активацию и мешает им совершить самоубийство. Поэтому он частый помощник злокачественных опухолей. Так, рак щитовидной железы, простаты, груди и многие другие используют галектин-3 для обеспечения себе усиленного кровоснабжения и облегчения метастазирования. Поэтому опухоль, которая активно «пользуется» галектином-3 как инструментом для выживания и роста, требует более пристального внимания врача [19].
Уже упоминалось, что галектин-3 способен активировать макрофагов. Вообще различают два пути активации макрофагов: классический и альтернативный. Классически активированный макрофаг выделяет активные формы кислорода и провоспалительные цитокины, словом, делает все, чтобы спровоцировать воспаление и нанести как можно больший урон инфекции и зараженной ткани. А альтернативно активированный более дружелюбен: он выделяет противовоспалительные вещества и синтезирует коллаген для заживления ран [20]. Под воздействием галектина-3 макрофаги активируются альтернативно. Казалось бы, вреда от таких гораздо меньше, чем от классически активированных, но при хроническом воспалении этот процесс приводит к фиброзу, то есть к разрастанию соединительной ткани и появлению рубцов.
Фиброз легкого — очень опасное заболевание. Ему подвержены люди с инфекционно-аллергическими заболеваниями или те, кто из-за специфики работы вынужден дышать пылью. Люди с фиброзом легкого испытывают постоянную гипоксию, которая со временем провоцирует сердечную недостаточность, слабость и неспособность вести полноценную жизнь. А самое грустное, что эффективного лечения фиброза легкого на данный момент не существует. Все, что врач может предложить пациенту — кислородная маска, трансплантация легкого или очень дорогое лекарство: «Эсбриет» компании Roche. Механизм действия «Эсбриета» до конца не ясен, и препарат обладает достаточно неприятными побочными эффектами: у каждого десятого пациента наблюдаются тошнота, усталость, диарея и кожные реакции. Чуть менее распространены воспаление мочевого пузыря, боль в груди, одышка и анорексия.
Между тем на животных моделях было показано, что галектин-3 — отличная мишень для лечения фиброза. Крыс с искусственно вызванным фиброзом печени кормили специфическими ингибиторами галектина-3, что позволило не только остановить патологический процесс, но и обратить его вспять [21].
За счет процессов фиброза в сердце галектин-3 участвует в развитии сердечнососудистых заболеваний. В группе пациентов с одновременно повышенными уровнями галектина-3 и натрийуретического пептида (а это основной маркер сердечного неблагополучия) смертность еще в 1,5–2 раза выше [22].
Что делать?
Биомолекула такой значимости, как галектин-3, ставит перед врачом две задачи. Во-первых, нужно определить уровень галектина-3 у пациента, и, если он повышен, снизить концентрацию до нормальной. На данный момент существует несколько специфических ингибиторов галектина-3 — углеводов и пептидов [21], [23]. С точки зрения применения в клинике все они имеют ряд недостатков, так как могут выводиться, не успев подействовать, или привлечь чересчур пристальное внимание иммунной системы. Поэтому наша научная группа задалась целью создать рекомбинантные человеческие антитела к галектину-3. Дело в том, что антитело — почти идеальное лекарство. Молекула человеческого антитела обладает минимальной иммуногенностью и высокой специфичностью. Конечно, на данный момент уже существуют антитела против галектина-3, но, поскольку они мышиные и кроличьи, годятся они только для исследований.
Половина пути позади
Для того чтобы найти антитела, нужно сперва получить рекомбинантный галектин-3, а желательно даже два: макаки и человека. Ведь если будущие антитела покажут терапевтическую активность, прежде чем лечить ими людей, нужно будет испытать их на обезьянах. Тут-то и начались мои приключения. Главная часть галектина-3 — это углеводсвязывающий домен, а значит, достаточно получить рекомбинантным способом только его. Бактерии, в которые мы поместили плазмиду с закодированным галектином-3, честно вырабатывали белок с нужной молекулярной массой, но коммерческие мышиные антитела упорно отказывались связываться с ним. Скорее всего, это было вызвано тем, что неполный белок был неправильно свернут.
Ничего не оставалось, кроме как начать все с самого начала и настроить синтез всего белка целиком. Покопавшись в литературе, я обнаружила, что галектин-3 можно выделить с помощью аффинной хроматографии на лактозил-сефарозе [24]. Найти в литературе внятную методику оказалось не так-то просто. Многое пришлось додумывать, полагаясь на логику и интуицию. Когда у меня в руках оказались две пробирки с очищенными галектинами-3, я испытала настоящий триумф!
Спустя еще несколько месяцев мы получили два антитела. Этого вполне достаточно для создания диагностической системы, с помощью которой можно будет измерить концентрацию галектина-3 в сыворотке крови. Единственное условие: наши антитела должны «хватать» галектин-3 за разные части (эпитопы). Это необходимо для корректной работы системы. Но оказалось, что два антитела, хоть они и различаются по аминокислотной последовательности, связывают галектин-3 за один и тот же эпитоп. Поэтому до создания диагностического набора пройдена только половина пути. Для завершения этого этапа необходимо разработать еще одно антитело, которое будет «ловить» галектин-3 за «другую руку».
Предстоит проделать большую работу, чтобы антитела к галектину-3 пришли в лаборатории клинической диагностики. А чтобы создать лекарство, потребуется еще больше усилий. Мы и впредь будем стараться сделать так, чтобы неоконченная история галектина-3 увенчалась счастливым концом.
Галектин-3: клиническая и прогностическая ценность определения у пациентов с ХСН
Гямджян К. А., Драпкина О. М., Максимов М. Л.
ГБОУ ВПО «Первый МГМУ имени И. М. Сеченова» МЗ РФ, 119991, Москва, ул. Трубецкая, д. 8, стр. 2 Ключевые слова: биомаркеры, галектин-3, диагностика, ХСН
Keywords: biomarkers, galectin-3, diagnostics, CHF
Ссылка на эту статью: Гямджян К. А., Драпкина О. М., Максимов М. Л. Галектин-3: клиническая и прогностическая ценность определения у пациентов с хронической сердечной недостаточностью. Журнал Сердечная Недостаточность. 2014;82 (1):51–55.
Резюме
В статье приводится обзор результатов исследований, в которых проводилось определение уровня в плазме крови галектина-3 (Г3) в качестве биомаркера ХСН.
Summary
The article provides a review of studies focused on measuring plasma levels of galectin-3 as a marker for CHF.
Хроническая СН в настоящее время является одним из наиболее распространенных и прогностически неблагоприятных заболеваний. ХСН страдает 2–4 % всего населения мира. По данным исследования ЭПОХА–ХСН, распространенность ХСН в РФ составляет 7 % (7,9 млн. человек) [1]. Несмотря на значительный прогресс в терапии ХСН за последние десятилетия, смертность от этого заболевания остается крайне высокой, достигая 60 % у мужчин и 45 % у женщин в течение 5 лет после установления первоначального диагноза [2]. В связи с этим разработка новых методов профилактики и лечения ХСН представляет собой актуальную медико-социальную проблему.
В настоящее время большой интерес представляет изучение новых биологических маркеров ХСН, которые могут служить полезным инструментом для мониторинга эффективности фармакотерапии (персонализированной медицины), ранней диагностики заболевания, прогноза его клинических исходов и играть важную роль в стратификации риска пациентов. На сегодняшний день в клиническую практику введен лишь один биомаркер ХСН – мозговой натрийуретический пептид (BNP). Последний выделяется кардиомиоцитами желудочков в виде прогормона и уже в кровотоке расщепляется на С-фрагмент (собственно мозговой натрийуретический гормон – BNP) и неактивный N-фрагмент (N-концевой фрагмент предшественника BNP или NT-proBNP) в соотношении 1:1 [3, 4] Определение уровня BNP и NT-ProBNP используется при скрининге бессимптомной дисфункции желудочков сердца, для определения диагноза и прогноза ХСН, для оценки эффективности терапии. Однако уровни BNP и NT-proBNP обладают достаточно большим межиндивидуальным разбросом значений и зависят от пола (у женщин содержание выше, чем у мужчин), возраста (содержание выше у пожилых), веса (при повышении веса тела уменьшается уровень гормона), наличия в анамнезе почечной недостаточности и мерцательной аритмии (содержание гормонов при этом возрастают) [4, 5] В связи с этим представляется актуальным поиск новых биомаркеров ХСН, способных возместить эти недостатки.
Галектин-3 принадлежит к семейству β-галактозид-связывающих протеинов. Благодаря наличию в своей структуре коллагеноподобного домена галектин связывается с широким спектром протеинов экстрацеллюлярного матрикса, таких как тенасцин, фибронектин и ламинин. Г3 экспрессируется многими клетками, включая нейтрофилы, макрофаги, лаброциты, фибробласты и остеокласты [6]. Г3 обнаружен в легких, желудке, кишечнике, матке и яичниках [6, 7].
Для Г3 характерны многочисленные аутокринные и паракринные свойства. Он ответственен за активацию нейтрофилов, лаброцитов и T-клеток, регуляцию клеток адгезии, запуск апоптоза и ангиогенеза. В зависимости от типа клеток и баланса между экстрацеллюлярным и интрацеллюлярным содержанием Г3 способен как игибировать, так и индуцировать рост и дифференциацию клеток [8].
Помимо аутокринных и паракринных свойств, Г3 играет также важную роль в защите организма от патогенов. Г3 усиливает провоспалительные сигналы, обладая хемотаксическими свойствами по отношению к макрофагам и моноцитам, индуцирует адгезию нейтрофилов и релиз провоспалительных факторов лейкоцитов и лаброцитов, участвует в фагоцитозе нейтрофилов макрофагами [9].
Экспрессия Г3 в кардиомиоцитах практически не обнаруживается, тогда как фибробласты миокарда экспрессируют высокие уровни этого лектина [10]. В недавних исследованиях Schroen с соавт. идентифицировали выраженную экспрессию, так называемую up-regulation, Г3 мРНК у крыс с моделью АГ [11]. В последующих исследованиях Schroen с соавт. обнаружили повышенный уровень миокардиального Г3 у животных с прогрессирующей СН. Ученые также отметили стимуляцию депозиции коллагена и ремоделирование миокарда в ответ на инфузию Г3 в полость перикарда [10]. Профибротический эффект Г3 был также выявлен при фиброзе печени, при дифференциации миофибробластов, а также в моделях крыс, получавших натуральный антифибротический пептид N-ацетил-серил-аспартил-лизилпролин. [12, 13]. В дополнение к вышесказанному последние исследования иллюстрируют роль Г3 в качестве медиатора альдостерон-индуцированного васкулярного фиброза [14]. Исследователями было показано дозозависимое нарастание экспрессии протеина Г3 в культуре гладкомышечных клеток сосудов (ГМКС) крыс в ответ на введение альдостерона в течение 24 ч, гиперэкспрессия же Г3, в свою очередь, в 1,6 раз повышала степень депозиции коллагена I типа в ГМКС крыс. Подобная альдостерон-индуцированная депозиция коллагена I типа может быть заблокирована с помощью либо Г3 нейтрализующих малых интерферирующих РНК (siRNA), либо с помощью химических ингибиторов углеводсвязывающей активности Г3. Позже приведенные in vitro данные были подтверждены авторами с помощью выявления повышенной экспрессии аортального Г3 и коллагена типа 1 у диких мышей в ответ на альдостерон, тогда как у мышей с инактивированным геном Г3 подобные изменения не наблюдались [14].
Таким образом, данные экспериментальных исследований, полученные с помощью применения различных моделей ССЗ, свидетельствуют о возможной биомаркерной функции Г3, являющегося индуктором фиброза и ремоделирования миокарда [15].
В последние годы опубликовано значительное количество клинических исследований, посвященных оценке Г3, как биомаркера ССЗ. Данные исследования подразделяются на 4 группы:
Диагностическая ценность галектина-3
В 2006 году группой ученых под руководством van Kimmenade R. R. было проведено исследование по изучению диагностической роли нового биомаркера Г3 у пациентов с острой СН. В исследование были включены 599 пациентов с одышкой и другими симптомами СН. У всех пациентов определялся уровень Г3 и NT-proBNP в плазме крови. В результате исследования было показано, что уровень Г3 не коррелировал с тяжестью состояния пациента, оценивавшейся согласно классификации NYHA, и характеризовался более низкой диагностической специфичностью и чувствительностью для идентификации СН в сравнении с NT-proBNP (анализ характеристических ROC кривых NT-proBNP и Gal-3: 0,94; p 30 нг / мл повышал риск наступления конечных точек (смерти и госпитализации по причине СН) в 2,05 раза (OR) [24].
Целью анализа в подгруппе исследования HF-ACTION (Heart Failure: A Controlled Trial Investigating Outcomes of exercise traiNing) явилось выявление корреляции между исходным уровнем Г3 плазмы и общей смертностью и госпитализацией больных ХСН с ФВ
Список литературы