Габапентин или финлепсин при невралгии тройничного что лучше
Габапентин или финлепсин при невралгии тройничного что лучше
Пфайзер Эйч Си Пи Корпорэйшн
Противоэпилептические препараты за рамками эпилепсии (применение антиконвульсантов в лечении болевых синдромов)
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2013;113(4-2): 58-65
Давыдов О. С. Противоэпилептические препараты за рамками эпилепсии (применение антиконвульсантов в лечении болевых синдромов). Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2013;113(4-2):58-65.
Davydov O S. Antiepileptic drugs: over than epilepsy (anticonvulsants drugs use in different pain syndromes). Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2013;113(4-2):58-65.
Пфайзер Эйч Си Пи Корпорэйшн
Пфайзер Эйч Си Пи Корпорэйшн
За прошедшие с момента появления первых антиконвульсантов годы появились обширная доказательная база и опыт применения этих препаратов в лечении различных форм эпилепсии, одновременно с этим наметился ряд точек приложения этих препаратов при лечении других заболеваний. В литературе имеются результаты исследования эффективности ПЭП при следующих заболеваниях и синдромах: невропатическая боль и фибромиалгия, мигрень, тревожные и биполярные расстройства, шизофрения, эссенциальный тремор [21].
Предпосылки для применения антиконвульсантов при невропатической боли
Ряд патофизиологических механизмов, характерных для невропатической боли, имеет аналоги при эпилепсии. Так, например, выявлено сходство между феноменом «взвинчивания», возникающим в задних рогах спинного мозга при невропатической боли, центральной сенситизацией и феноменом «киндлинга» или формирования «генераторов патологического возбуждения» в гиппокампальных нейронах при эпилепсии. Считается, что оба феномена, наряду с другими механизмами, возникают вследствие активации NMDA-рецепторов. Не удивительно, что антиконвульсанты показывают свою эффективность как с точки зрения уменьшения количества приступов эпилепсии, так и с точки зрения подавления интенсивности болевого синдрома [13, 17, 37].
Механизмы действия антиконвульсантов при болевых синдромах
Механизмы действия антиконвульсантов при невропатической боли различны. Антиболевой эффект таких препаратов, как карбамазепин, фенитоин, окскарбазепин, ламотриджин, вальпроаты, топирамат, принято объяснять уменьшением высокочастотной повторяющейся импульсации нейронов посредством блокирования потенциалзависимых натриевых и кальциевых каналов в периферических нервах. Ряд препаратов (например, фенобарбитал, тиагабин, топирамат, вигабатрин и вальпроаты) усиливают нервную передачу подавляющих боль импульсов, либо непосредственно блокируют нервную передачу возбуждающих импульсов. Прегабалин и габапентин имеют принципиально иной механизм действия, связанный с воздействием на альфа-2-дельта-субъединицу потенциалзависимых кальциевых каналов и подавлением процессов центральной сенситизации в заднем роге спинного мозга и в головном мозге. Обобщенные данные по механизмам действия антиконвульсантов представлены в табл. 1.
Помимо перечисленных в табл. 1 предполагаемых механизмов действия антиконвульсантов рассматриваются также их возможное опосредованное воздействие на различные нейротрансмиттерные системы и влияние на внутриклеточные процессы. На сегодняшний день обсуждается вопрос, является ли одинаковым механизм реализации терапевтического эффекта одного и того же антиконвульсанта при различных состояниях: эпилепсии, болевых синдромах, тревоге и др. через сходные механизмы или эти механизмы различаются [21].
На основании проведенного метаанализа и систематических обзоров такие авторитетные международные организации, как Европейская федерация неврологических обществ, Группа по изучению невропатической боли при Международной ассоциации по изучению боли и др., опубликовали рекомендации по терапии невропатической боли и выделили несколько направлений (линий) терапии этого состояния. В большинстве документов выделяют препараты первой линии, т.е. те препараты, с которых следует начинать лечение, а при неэффективности или непереносимости заменять на другой препарат этой же линии, а также средства второй и третьей линий, а в некоторых рекомендациях предлагается даже выделять препараты четвертой линии. Авторы рекомендаций сходятся в одном: на сегодняшний день среди антиконвульсантов только прегабалин и габапентин являются препаратами первой линии при терапии невропатической боли. Доказательства эффективности карбамазепина имеются только при тригеминальной невралгии [32] (табл. 3).
Важно подчеркнуть, что рассматриваемый подход к терапии невропатической боли основан на доказательствах, полученных в исследованиях, где учитывался опыт не только каждого специалиста, но были обобщены и соответствующие мировые данные [32]. Эти же позиции отражены и в рекомендациях группы российских экспертов [4].
Карбамазепин (тегретол, финлепсин, актинервал, зептол и др.) относится к ПЭП первого поколения и по химическому строению близок к трициклическим антидепрессантам. Карбамазепин имеет широкий спектр показаний, помимо других заболеваний включающий состояния, сопровождающиеся невропатической болью: невралгию тройничного нерва, языкоглоточную невралгию и болевую диабетическую полиневропатию. Большинство хорошо спланированных исследований проведены у пациентов с тригеминальной невралгией и лицевой болью, где препарат доказал свою эффективность. Данные по его эффективности при других типах невропатической боли ограничены (небольшое число проведенных испытаний и участвовавших пациентов). В связи с этим в ряде рекомендаций по лечению невропатической боли карбамазепин рекомендован как препарат первой линии терапии только для тригеминальной невралгии [17]. Карбамазепин обычно принимают независимо от приема пищи, с небольшим количеством жидкости. У взрослых лечение рекомендуют начинать с дозы 100-200 мг 1 или 2 раза в день, постепенно повышая ее не более чем на 200 мг в сутки, до купирования боли (в среднем это 800-1200 мг в день), а затем снижают ее до минимально эффективной дозы. В некоторых случаях может потребоваться доза 1600 мг в день, что предполагает тщательную титрацию и наблюдение за пациентом. Карбамазепин противопоказан при атриовентрикулярной блокаде, нарушении кроветворения, острой перемежающейся порфирии, в том числе в анамнезе, а также одновременно с ингибиторами моноаминоксидазы.
При применении карбамазепина зарегистрирован ряд серьезных побочных эффектов, таких как синдром Стивенса-Джонсона (на 1999 г. в мире зарегистрировано 544 случая), острый эпидермальный некролиз, агранулоцитоз, апластическая анемия, гепатит, нарушение почечной функции, эндокринные нарушения. К наиболее частым побочным эффектам (10% и больше) карбамазепина относятся: головокружение, атаксия, сонливость, крапивница, мультиорганные реакции гиперчувствительности, васкулиты, лейкопения, тошнота, рвота, отеки, повышение массы тела. Риск развития этих явлений повышен при учете неблагоприятных лекарственных взаимодействий. С осторожностью следует назначать карбамазепин у пожилых больных [5, 6].
Поэтому карбамазепин следует применять только при условии регулярного врачебного контроля. Перед началом лечения рекомендуется сделать анализ мочи, развернутый биохимический анализ крови, включая уровень мочевины. Эти показатели следует контролировать сначала еженедельно, а затем ежемесячно. В процессе лечения необходимо также регулярно контролировать функцию печени, состояние крови, в том числе концентрацию электролитов в сыворотке [14].
Окскарбазепин (трилептал) имеет структурное сходство с карбамазепином. Считается, что эффективность этих препаратов при эпилепсии вполне сопоставима, но окскарбазепин лучше переносится. Например, при применении препарата не зарегистрировано ни одного случая синдрома Стивенса-Джонсона. Для окскарбазепина было проведено несколько клинических исследований при тригеминальной невралгии с положительным результатом. Рекомендуемый режим дозирования 900-1800 мг в сутки. В ряде рекомендаций по лечению невропатической боли окскарбазепин показан как препарат первой линии терапии для тригеминальной невралгии. Окскарбазепин по этому показанию в России не зарегистрирован [17].
Габапентин в ряде международных рекомендаций признан препаратом первой линии терапии невропатической боли [32]. Помимо оригинального препарата нейронтин в России зарегистрирован ряд дженериков: гапентек, тебантин, габагамма, конвалис и др. В 9 крупных рандомизированных плацебо-контролируемых исследованиях была показана эффективность габапентина при постгерпетической невралгии и диабетической полиневропатии. По одному плацебо-контролируемому исследованию было проведено при фантомной боли, синдроме Гийена-Барре, невропатической боли различной этиологии, боли невропатического характера, вызванной онкологическим заболеванием, травме спинного мозга. По результатам клинических исследований препарат показал свое превосходство над плацебо при купировании боли и его хорошую переносимость больными [26].
В отсутствие нейротрансмиттеров в синаптической щели распространение импульса на следующий нейрон блокируется [13, 23].
Прегабалин (лирика) на сегодняшний день позиционируется во всех международных и Российских рекомендациях по лечению невропатической боли и болевой диабетической полиневропатии в качестве препарата первой линии терапии [4, 32]. Прегабалин, как и габапентин, относится к классу средств, имеющих высокую аффинность к альфа-2-дельта-протеину в центральной нервной системе. Прегабалин представляет собой дериват ГАМК и является по сути ее аналогом. В исследованиях на фоне приема препарата было продемонстрировано уменьшение высвобождения ряда нейротрансмиттеров (включая глутамат, норадреналин и субстанцию Р) в гипервозбужденных нейронах. Считается, что это вызвано модуляцией функции альфа-2-дельта-субъединицы потенциалзависимых кальциевых каналов. Прегабалин, уменьшая выделение нейротрансмиттеров, замедляет таким образом передачу нервного импульса на следующий нейрон, что в результате приводит к редукции болевого синдрома. Важно отметить, что прегабалин оказывает эффект только в условиях гипервозбуждения нейронов при патологических состояниях; его модулирующее действие приводит к переходу нейронов в нормальное состояние [13, 18, 23].
В литературе отражен обширный опыт постмаркетингового применения прегабалина. Так, в Германии было проведено его исследование при лечении 10 300 пациентов с такими формами патологии, как диабетическая полиневропатия, боль в спине с невропатическим компонентом, постгерпетическая и тригеминальная невралгия, алкогольная полиневропатия, другие различные полиневропатии и невропатическая боль вследствие опухоли. Достоверное снижение интенсивности боли отмечалось уже на 1-й неделе терапии. К 6-й неделе лечения прегабалином интенсивность боли снизилась в среднем на 62%, при этом у пациентов улучшались сон и настроение [24].
Имеется опыт использования препарата у пациентов с тяжелой, не купирующейся другими средствами, болью. В одном открытом исследовании [24] у пациентов с болью, рефрактерной к терапии габапентином, трициклическими антидепрессантами или другими препаратами, применение прегабалина достоверно уменьшало интенсивность боли по визуальной аналоговой шкале и выраженность тревоги и нарушений сна [25].
Препарат исследован также и при центральной невропатической боли у пациентов, перенесших травму спинного мозга, в ходе 12-недельного рандомизированного плацебо-контролируемого исследования. На фоне терапии прегабалином интенсивность боли у этой группы пациентов уменьшалась, начиная с 1-й недели терапии, а эффект сохранялся до конца курса лечения. Параллельно с обезболиванием применение препарата вызывало стойкое улучшение сна. Еще в одном исследовании прегабалин был эффективнее плацебо у пациентов с центральной постинсультной болью [30, 34].
Как уже указывалось, прегабалин хорошо переносится. Наиболее частыми побочными эффектами являются головокружение и сонливость. Как показывают данные клинических исследований, головокружение и сонливость на фоне приема прегабалина имеют транзиторный характер, возникая через 1-2 дня приема и прекращаясь на 2-4-й неделе терапии [25]. К другим побочным эффектам относятся: атаксия, дизартрия, нарушение внимания, эйфория, раздражительность, диплопия, сухость во рту, утомляемость, отеки, транзиторное повышение массы тела. Прегабалин не метаболизируется в печени и не связывается с белками плазмы, поэтому риск взаимодействия с другими лекарствами минимален.
Другие антиконвульсанты для лечения невропатической боли. Ламотриджин (ламиктал, конвульсан, ламолеп, ламиктор) является антиконвульсантом второго поколения и зарегистрирован для лечения эпилепсии и биполярных расстройств. При невропатической боли эффективность препарата была показана при болевой форме диабетической нейропатии, спинальной травме, тригеминальной невралгии, центральной постинсультной боли, однако в некоторых других исследованиях были получены противоречивые результаты. Топирамат (топамакс, топиромакс, макситопир и др.) показал эффективность в снижении боли при диабетической невропатии и спинальной травме, в других исследованиях эффект был недостаточным. Лакосамид (вимпат), на стадии клинических исследований вселявший определенные надежды на эффективность, не оправдал ожиданий в отношении терапии болевых синдромов. Следует также учитывать отсутствие невропатической боли в официальном перечне показаний для всех трех препаратов [18, 20, 38, 39].
Применение антиконвульсантов при мигрени, тревожных расстройствах и фибромиалгии
Применение антиконвульсантов при мигрени рассматривается только в рамках профилактической терапии приступов. Согласно рекомендациям Американской академии неврологии, для того чтобы начинать профилактическую терапию, таких приступов должно быть не менее 2 в месяц, или приступы должны быть тяжелыми, рефрактерными к лечению и приводящими к дезадаптации пациента [31]. Среди возможных механизмов профилактического действия антиконвульсантов рассматривается их влияние на систему ГАМК-глутамат или на внутриклеточные медиаторы (АТФ, ц-АМФ, протеинкиназа С и др.) посредством воздействия на кальциевые или натриевые каналы синапса. В США топирамат и вальпроаты зарегистрированы FDA для профилактики мигрени, но в России эти показания не фигурируют [31, 37].
Гипотетическую возможность применения большинства антиконвульсантов при тревожных расстройствах связывают с воздействием на трансмиссию ГАМК. Наиболее доказанным действием в отношении тревоги являются тиагабин, габапентин и прегабалин, причем последний официально зарегистрирован как в США, так и в России для лечения генерализованного тревожного расстройства. Механизм анксиолитического действия прегабалина связывают с пресинаптическим ингибированием высвобождения возбуждающих нейротрансмиттеров, а в качестве доказательства его эффективности опубликованы результаты более 7 рандомизированных плацебо-контролируемых исследований [35].
Одним из заболеваний, также до определенной степени поддающихся лечению антиконвульсантами, является фибромиалгия, или как ее еще называют, синдром индивидуальной гиперчувствительности к боли, заболевание, наиболее трудно поддающееся лечению. Из известных на сегодня антиконвульсантов в его лечении доказал свою эффективность только прегабалин, исследованный как в коротких, 8-недельных, так и в длительных, продолжительностью более года, исследованиях. Наличие достаточных доказательств позволило Европейской противоревматической лиге рекомендовать включение этого препарата в состав комплексной терапии фибромиалгии. Механизм действия прегабалина при фибромиалгии связывают с воздействием на процессы центральной сенситизации [12, 19].
Сравнительный анализ эффективности комплексной фармакотерапии боли при невралгии тройничного нерва
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Лицевые боли (прозопалгии) – одна из наиболее частых причин обращаемости больных к неврологам, стоматологам и врачам других специальностей.
Боли в области лица могут быть вызваны поражением нервного аппарата челюстно-лицевой области (системы тройничного, языкоглоточного нервов, вегетативных узлов и сплетений) или мышечно-суставной дисфункцией при артрозоартрите височно-нижнечелюстного сустава и нарушении соотношения зубных рядов. Кроме того, описаны рино- и офтальмогенные прозопалгии, патогенез которых сложен, однако в конечном итоге реализуется через неврогенные и мышечные механизмы.
В клинической практике среди краниальных невралгий наиболее часто встречается тригеминальная невралгия, или невралгия тройничного нерва (НТН). Распространенность НТН – 45–50 на 100 тыс. населения с пиком заболеваемости на 6-м десятилетии жизни. Патогенез заболевания сложен. Доказано, что пусковым моментом является корешково-сосудистый конфликт в области мостомозжечкового угла, приводящий к сегментарной демиелинизации корешка тройничного нерва. Сочетание демиелинизации корешка с функциональной и/или структурной дефектностью антиноцицептивных регуляторных систем у данного индивидуума может способствовать формированию так называемого «генератора патологической активности» в системе тройничного нерва и служить основой развития клинической картины НТН [5].
Клиническая картина невралгии тройничного нерва
Больные предъявляют жалобы на пароксизмальную боль, сравнимую с ударом электрического тока. Продолжительность болевого пароксизма не превышает 2 мин., хотя больные могут жаловаться на непрерывную боль. Однако при внимательном расспросе удается установить наличие «светлого» безболевого промежутка между приступами.
Характеристика болевого пароксизма:
1. Боль чрезвычайно сильная и при определении ее интенсивности по 10-балльной шкале боли соответствует 8–10 баллам.
2. Рисунок боли в период обострения не изменяется (боль не может перемещаться на противоположную сторону) и соответствует корешково-сегментарной зоне иннервации.
3. Между двумя отдельными приступами всегда имеется безболевой (рефрактерный) период.
4. Наличие триггерных зон – гиперсенситивных участков на коже лица или в полости рта, слабое раздражение которых вызывает типичный болевой приступ. Триггерные зоны наиболее часто локализуются в медиальных отделах лица или на альвеолярных отростках челюстей.
5. Наличие триггерных факторов – действий или условий, при которых возникают типичные болевые пароксизмы. Наиболее часто такими факторами являются: умывание, прием пищи, движения нижней челюсти.
6. Типичное болевое поведение – во время приступа больные «замирают» в той позе, в которой их застал приступ.
7. На высоте приступа могут быть подергивания лицевой мускулатуры.
8. Отсутствие сенсорного дефекта на лице в дебюте заболевания.
При клинико-неврологическом обследовании на стороне боли может быть отмечено снижение вибрационной чувствительности и корнеального рефлекса. Также во время обострения НТН при наличии активных триггерных зон положителен симптом Штернберга – указывая локализацию триггерной зоны, больной не касается лица из-за боязни вызвать приступ.
Течение заболевания хроническое. У 2/3 больных в дебюте отмечаются легкие пароксизмы боли в проекции зубов, что может быть поводом для их удаления, у 1/3 уже в начале заболевания развиваются пароксизмы интенсивной боли, которые продолжаются 2–3 нед. и проходят самостоятельно. Как правило, через полгода или год приступы возобновляются в более тяжелой форме. В развернутой стадии заболевания обострения (периоды интенсивной боли), развивающиеся чаще в холодное время года, продолжаются 4–8 нед., затем стихают, но без адекватного лечения полностью не проходят. В начале заболевания ремиссии (период стихания болей) могут быть спонтанными, однако, как показывает наш клинический опыт, с течением времени их удается достичь только при адекватной терапии.
По мере развития заболевания, вероятно в связи с нарастанием демиелинизирующего процесса в области корешка тройничного нерва, формируется невропатическая стадия невралгии, когда в клинической картине, наряду с пароксизмами боли, отмечается незначительная постоянная боль. В этой стадии при клинико-неврологическом обследовании выявляется постоянный или преходящий сенсорный дефект периферического типа в зоне иннервации второй и/или третьей ветвей тройничного нерва.
Диагностика типичной НТН не представляет значительных трудностей, однако следует помнить, что пароксизмальная прозопалгия может быть симптоматической, т. е. обусловленной патологическими процессами в области мостомозжечкового угла (опухоль вестибуло-кохлеарного нерва, слипчивый оболочечный процесс и др.). В этой связи больные с впервые выявленной НТН в возрасте до 50 лет, а также с наличием в неврологическом статусе симптомов очагового поражения нервной системы нуждаются в МРТ-обследовании головного мозга.
Лечение невралгии тройничного нерва
Лечение боли при НТН до настоящего времени представляет сложную задачу. В 1962 г. С. Блюм предложил лечить невралгию тройничного нерва карбамазепином. В настоящее время, наряду с карбамазепином, применяются и другие противоэпилептические препараты: габапентин, окскарбазепин, прегабалин (Лирика).
Лечение карбамазепином рекомендуется начинать с 50 мг (1/4 стандартной таблетки, содержащей 200 мг карбамазепина) 3 р./сут во время или после еды, запивая достаточным количеством жидкости [3]. Повышать дозу карбамазепина при хорошей переносимости можно на 50 мг ежедневно. Средняя эффективная доза составляет 600–800 мг/сут. Доза считается эффективной, если болевой синдром купирован полностью (раздражение триггерных зон и триггерные факторы не вызывают болевого пароксизма – больной может принимать пищу и безболезненно выполнять гигиенические процедуры умывания и чистки зубов).
Дальнейшее лечение в течение 3–4 нед. проводится с применением индивидуальной эффективной дозы препарата, что позволяет достичь медикаментозной ремиссии. Затем проводится обратное титрование со снижением суточной дозы на 50 мг в течение 5–7 дней. Целью обратного титрования является достижение индивидуальной поддерживающей дозы, которая может составлять от 100 до 400 мг/сут. В дебюте заболевания у части больных (40–60%) удается полностью отменить препарат. Возможно применение пролонгированных фармакологических форм карбамазепина, которые особенно удобны для проведения поддерживающей терапии.
При лечении препаратами карбамазепина следует помнить, что длительное применение больших доз может привести к развитию побочных явлений в виде головокружения, тошноты, атаксии. Описаны случаи апластической анемии. Поэтому, наряду с клиническим контролем развития возможных побочных эффектов препарата, необходимо следить за состоянием периферической крови и печени (общий анализ крови и содержание АСТ и АЛТ каждые 3 мес.).
Примерно у 15% больных карбамазепин неэффективен. Таким больным подбирают противоэпилептические препараты других групп.
В настоящее время сформулированы основные принципы рациональной полифармакотерапии, предполагающие воздействие на основные патогенетические механизмы нейропатической боли при НТН: периферическую и центральную сенситизацию с одновременной активизацией антиноцицептивной системы [5]. В схемах лечения нейропатической боли применяются местные анестетики, блокирующие проведение болевых импульсов на периферическом уровне, что при НТН технически невыполнимо; опиоидные анальгетики, оказывающие центральное действие, и адъювантные анальгетики, к которым можно отнести антидепрессанты, усиливающие ингибирующее влияние антиноцицептивных систем, и противоэпилептические препараты, тормозящие проведение ноцицептивных стимулов на сегментарном и супрасегментарном уровнях. Эффективность препаратов, применяемых в различных комбинациях в предлагаемых схемах, различна [3]. В этой связи изучение эффективности и безопасности применения прегабалина (Лирика) и карбамазепина в комплексном лечении НТН представляется своевременным и актуальным.
Целью настоящего исследования является совершенствование методов комплексного лечения пациентов, страдающих НТН в стадии обострения, посредством сравнительного анализа терапевтической эффективности прегабалина (Лирика) и карбамазепина в комплексном лечении.
Материалы и методы
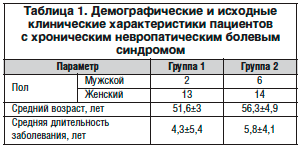
В настоящее исследование были включены 35 пациентов с НТН. Длительность заболевания – от 2 до 11 лет. Все наблюдаемые находились на амбулаторном лечении в консультативно-диагностическом центре Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского. Возраст больных – от 48 до 63 лет. Критериями включения в исследование были: обострение хронического болевого синдрома не более 2-х нед.
В стандартное комплексное лечение входили витаминотерапия, антиоксиданты, анксиолитики, антидепрессанты и противоэпилептические препараты.
Научным обоснованием применения антидепрессантов являются данные о недостаточности (функциональной и/или морфологической) антиноцицептивных систем. Известно, что антиноцицептивные системы осуществляют ингибирующий контроль сегментарного ноцицептивного аппарата челюстно-лицевой области, расположенного в каудальной части ядра спинального тракта тройничного нерва. Указанные системы, к которым относится околоводопроводное серое вещество, крупноклеточное ядро ствола головного мозга, голубое пятно и др., являются серотонин- и норадреналинергическими и участвуют, наряду с антиноцицептивным контролем, в эмоциональных реакциях человека. Поэтому применение препаратов с агонистическими моноаминергическими свойствами при лечении хронической боли является вполне обоснованным.
Возможно использование антидепрессантов различных фармакологических групп: трициклические (амитриптилин), селективные ингибиторы обратного захвата серотонина (флуоксетин), селективные ингибиторы обратного захвата серотонина и норадреналина, агонисты мелатониновых рецепторов. В нашем наблюдении применялся пипофезин (атипичный трициклический антидепрессант) в дозе 75 мг/сут.
В программу комплексной фармакотерапии НТН были включены противоэпилептические препараты. В зависимости от применяемого комплекса лечения все пациенты были разделены на 2 группы.
Группа 1 (15 человек) получала карбамазепин (средняя суточная доза карбамазепина составила 700±230 мг), группа 2 (20 человек) получала прегабалин (Лирика): 8 пациентов в дозе 450 мг/сут, 12 – 600 мг/сут. В комплексную фармакотерапию пациентов обеих групп входил пипофезин 75 мг/сут.
В обеих группах не выявлено достоверных различий по возрастному и половому составу (табл. 1).
У наблюдаемых пациентов с НТН было типичное течение заболевания – обострение начиналось с простреливающих болей в проекции одного или двух зубов, активизации имевших место ранее триггерных зон, которые располагались в медиальной части лица (верхняя губа, крыло носа) или в пародонте зубов. В подавляющем большинстве случаев провоцирующим обострение фактором явились резкое изменение АД, стресс, перепады температур. Далее развивались приступы интенсивной боли. У пациентов имелись активные триггерные зоны, раздражение которых (умывание, еда, бритье) вызывало пароксизм боли.
Результаты
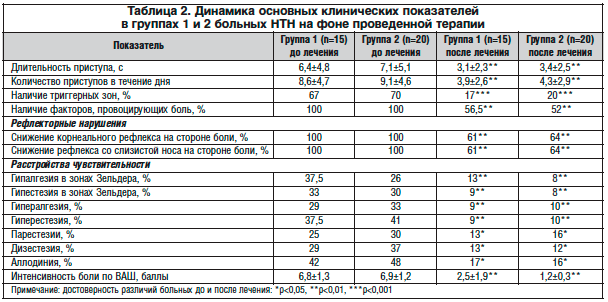
Динамика клинических показателей в группах наблюдения представлена в таблице 2.
Как следует из таблицы 2, в начале наблюдения интенсивность боли по ВАШ в группе 1, в комплексное лечение в которой входил карбамазепин, в среднем составила 6,8±1,3 балла, в группе 2, в комплексное лечение в которой входил прегабалин (Лирика), – 6,9±1,2 балла.
Исходный уровень депрессии по шкале Бека до лечения в обеих группах был достоверно высокий (27 и более баллов) (р 0,1).
Экстероцептивная супрессия произвольной активности височной и жевательной мышц. При регистрации экстероцептивной супрессии (ЭC) произвольной ЭМГ-активности жевательной и височной мышц с обеих сторон как в группе 1, так и в группе 2 достоверных изменений латентного периода (ЛП) и длительностей ЭС1 после лечения обнаружено не было (p>0,1). Основные изменения, выявленные у больных с НТН после курса проведенной терапии, касались параметров поздней ЭС2. В обеих группах больных после лечения наблюдалось достоверное уменьшение величины ЛП и увеличение длительности периода ЭС2 ЭМГ активности височной и жевательной мышц при регистрации как с больной, так и со здоровой стороны, которые, однако, не достигали значений этих параметров, зарегистрированных у здоровых испытуемых (p Литература
Только для зарегистрированных пользователей