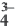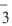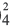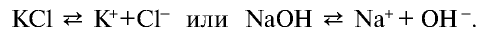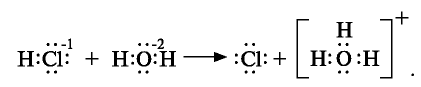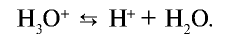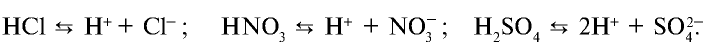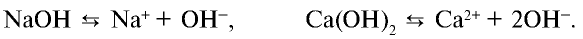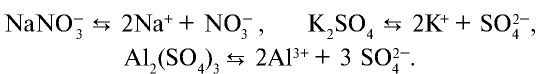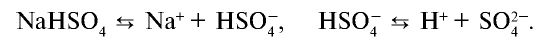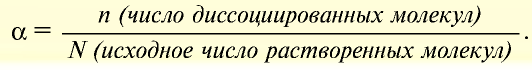Что влияет на степень диссоциации
Теория электролитической диссоциации
Что такое электролитная диссоциация? В следствие чего она образуется и какие факторы влияют на ее степень? Как научиться составлять уравнения диссоциации?
Кто открыл способность некоторых растворов проводить электрический ток и почему великий русский химик Д.И.Менделеев не получил Нобелевской премии?
Ответы на все эти вопросы вы узнаете из этой статьи.
История вопроса
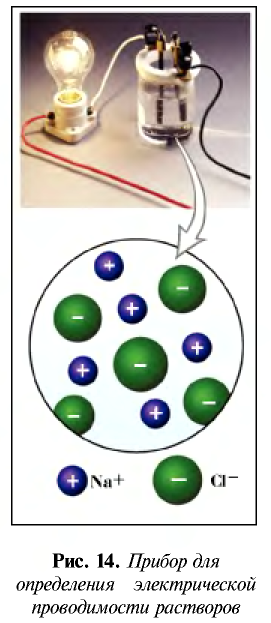
Изучение растворов с давних времен занимало умы исследователей. В начале XIX века М. Фарадей открыл способность некоторых растворов проводить электрический ток. Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью распадаются на ионы, то есть существует электролитическая диссоциация. Однако увеличение электропроводности с уменьшением концентрации раствора объяснить не смог.
Ученые заметили, что растворы замерзают при более низкой температуре, чем чистые растворители. Именно этим свойством растворов и в наше время пользуются дворники, щедро посыпая солью обледеневшие тротуары. Однако, температура замерзания электролитов не соответствовала расчетным данным.
Научным несостыковкам требовалось найти объяснение. И молодой, 29-летний шведский ученый С. Аррениус, в 1887 г. исследуя проведение электрического тока в растворах различных веществ, выдвинул теорию, которая могла объяснить эти факты.
Основные положения теории электролитической диссоциации
Степень диссоциации
В ходе научных исследований ученые определили, что в растворе диссоциирует некоторая часть молекул растворителя. Для количественной характеристики силы электролита был введен показатель степени диссоциации, который обозначается α и рассчитывается по формуле
Где ν — количество вещества, распавшееся на ионы,
ν0 — общее количество вещества.
Степень диссоциации также можно выразить в процентах. Как это сделать, можно узнать в § 11 учебника «Химия. 9 класс» под редакцией В.В. Еремина.
В зависимости от степени диссоциации вещества делят на сильные и слабые электролиты.
Сильные электролиты представляют собой вещества, которые в разбавленных растворах практически полностью распадаются на ионы. Степень диссоциации более 0.5, или 50%.
Для слабых электролитов значение степени диссоциации α меньше 0.1, или 10%.
Вещества с промежуточными значениями от 10 до 50% иногда называют средними электролитами.
Уравнение диссоциации
Уравнение электролитической диссоциации используют для записи процессов, происходящих в растворе.
Диссоциация сильного электролита протекает практически необратимо, что показывает стрелка →.
Диссоциация слабого электролита — обратимый процесс, протекает не полностью и не до конца, что обозначает стрелка ⇄
Умение составлять уравнения диссоциации будет отличным подспорьем при разборе темы «§ 13. Реакции ионного обмена и условия их протекания» в учебнике «Химия. 9 класс» под редакцией В.В. Еремина и для решения ионных уравнений.
Противостояние титанов
Теория электролитической диссоциации Аррениуса вызвала жаркие споры среди ученых.
Химический мир разделился на два лагеря. Сторонники «физической» теории Аррениуса считали, что распад на ионы происходит без какого-либо воздействия сил внешней среды и раствор представляет собой механическую взвесь ионов и молекул воды.
Но эта теория не могла объяснить тепловые эффекты при растворении. Например, нагревание колбы при разведении в воде серной кислоты или покрытие сосуда инеем при растворении в воде аммиачной селитры или азотнокислого аммония.
Сторонники «химической», или гидратной, теории, автором которой был Д.И. Менделеев, считали, что в растворе происходит взаимодействие растворенного вещества и растворителя.
Много копий было сломано в этой борьбе. Проявились худшие человеческие качества. Так, Аррениус, пользуясь служебным положением (в 1905 году он был назначен директором физико-химического Нобелевского института в Стокгольме), приложил массу усилий, чтобы, несмотря на трехкратную номинацию на получение Нобелевской премии в 1905, 1906 и 1907 годах, Д.И. Менделеев так ее и не получил.
Но истина, как всегда, оказалась посередине: в ходе дальнейших экспериментов ученые выяснили, что растворитель и растворенное вещество, взаимодействуя между собой, дают необходимую энергию для разрушения кристаллической решетки электролитов. В споре великих умов родилась новая протолитическая, или протонная, теория кислот и оснований.
Факторы, влияющие на величину степени диссоциации
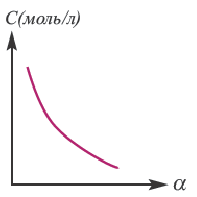
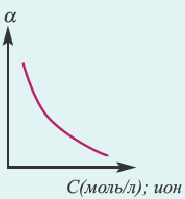
1. Концентрация раствора электролита. С увеличением концентрации раствора степень диссоциации уменьшается. Чем меньше концентрация электролита в растворе, тем больше степень диссоциации (см. далее закон разбавления Оствальда). При бесконечном разбавлении раствора степень диссоциации приближается к 1 (100 %).
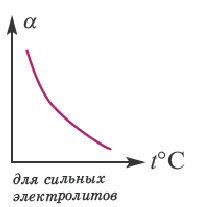
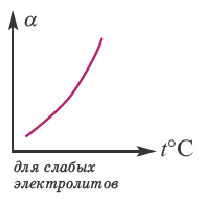
2. т емпература. С повышением температуры степень диссоциации увеличивается.
3. Добавление электролита, содержащего одноименные ионы. При добавлении к раствору слабого электролита одноименных ионов степень диссоциации данного электролита уменьшается. Например, добавим к раствору уксусной кислоты раствор сильного электролита ацетата натрия:
В результате увеличилась концентрация ацетат-ионов, равновесие ионизации уксусной кислоты сместилось влево, уменьшилась концентрация ионов Н + и, соответственно, уменьшилась степень диссоциации.
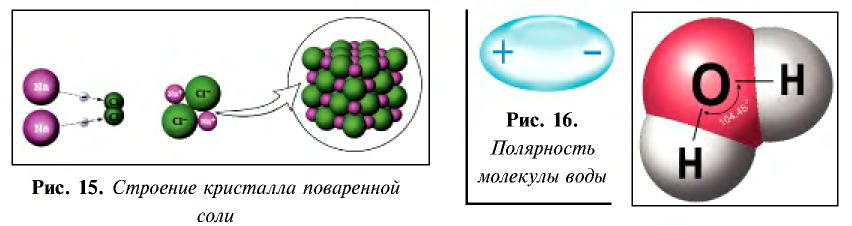
4. Природа растворителя. Чем полярнее растворитель, тем выше в нем степень диссоциации. Самый полярный растворитель – вода, поэтому в водных растворах степень диссоциации самая высокая.
5. Природа растворенного вещества. Как уже было сказано выше, по степени диссоциации все электролиты делят на три группы: слабые, средней силы и сильные.
Сильные и слабые электролиты
| Сильные электролиты (a → 1) | Слабые электролиты (a → 0) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| HCl, HBr, HI, HNO3, H2SO4, HMnO4, HClO4, H2SeO4 | H2CO3, H2S, H3PO4, H2SiO3, HCN, HNO2, HCOOH, CH3COOH, H2SO3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Щелочи: LiOH, NaOH, KOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 | Все нерастворимые в воде основания: Cu(OH)2, Fe(OH)2 и др., а также гидрат аммиака NH3∙H2O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11Na 0 l s 2 ∕2s 2 2p 6 ∕3s 1 Электронная формула атома натрия | 11Na + ls 2 ∕2s 2 2p 6 / Электронная формула иона натрия |
| 11Na 0 l)2e 2)8e 3)1е Схема строения атома натрия | 11Na + l)2e 2)8е Схема строения иона натрия |
| Восстановитель | Окислитель |
Несмотря на все это, С.Аррениус не смог полностью раскрыть сущность процесса электролитической диссоциации. Он не учитывал роль молекул растворителя и полагал, что в водном растворе находятся свободные ионы. При диссоциации электролитов в растворе образуются положительно и отрицательно заряженные частицы, состоящие из одного или нескольких атомов.
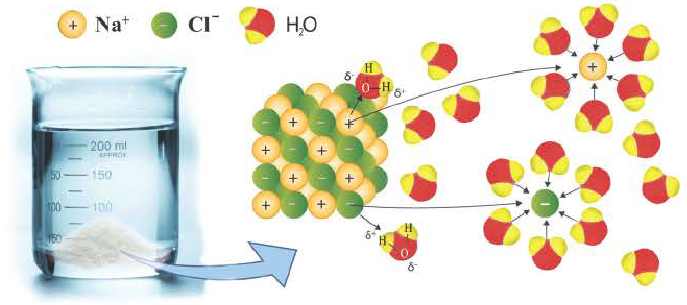
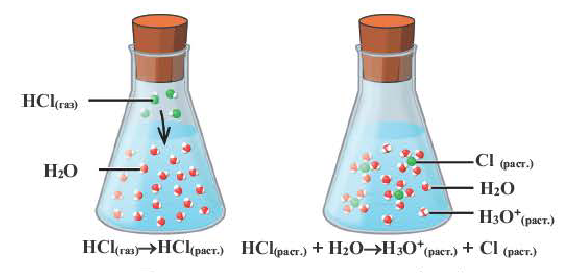
Диссоциация водного раствора хлорида натрия
Наряду с веществами, кристаллическая решетка которых имеет ионное строение, молекулы с полярной ковалентной связью также в воде распадаются на ионы. При растворении в воде хлорида водорода (хлороводорода) с полярно-ковалентной связью под действием полярных молекул воды связь между атомами разрывается. Молекула хлорида водорода распадается на два гидратированных иона. Электронная пара переходит к атому хлора, в результате полярная ковалентная связь превращается в ионную связь.
Диссоциация молекулы хлороводорода
Процесс диссоциации характеризуется степенью диссоциации.
Отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе, называется степенью диссоциации и обозначается знаком а (альфа).
Здесь а показывает степень диссоциации,n число диссоциированных молекул, N— общее число растворенных молекул.
Величина а принимает значения между 0÷1, при выражении в процентах между 0÷100%.
Если α=0, значит, диссоциация не произошла.
Если α=1 или а= 100%, значит, электролит полностью диссоциировал на ионы.
Величина n может принимать разные значения от 0 до N.
По значению степени диссоциации электролиты делят на три группы.
| Сильные Электролиты | Электролиты средней силы | Слабые электролиты |
| a ≥ 30% | a=3 ÷ 30% (или 0,03 ÷ 0,3) | a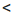 3% 3% (или a 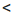 0,03) 0,03) |
| Щелочи: LiOH, NaOH, КОН, RbOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 Растворимые в воде соли, сильные кислоты | Mg(OH)2, H3PO4, H2C2O4 (щавелевая кислота) | NH4OH, H2CO3, H2S, HCN, H2O, CH3COOH и другие органические кислоты |
Электролиты, которые при растворении в воде или расплаве полностью диссоциируются на ионы, называются сильными электролитами.
Электролиты, которые при растворении в воде или расплавлении частично диссоциируются на ионы, называются слабыми электролитами.
Факторы, влияющие на степень диссоциации
Значение степени диссоциации зависит от ряда факторов.
Природа электролита (характер связи в молекуле электролита). Слабые и средней силы электролиты диссоциируют в растворе частично, а сильные электролиты полностью.
Природа растворителя
Диэлектрическая постоянная показывает, во сколько раз сила взаимодействия между двумя электрическими зарядами, находящимися в определенной среде, меньше по отношению к вакууму. Поскольку диэлектрическая постоянная воды (проникающая способность) при 20 o C высокая, способность ионизации также сравнительно высокая. Численное значение ее диэлектрической постоянной (81) показывает, что сила взаимодействия между ионами в растворе с водной средой в 81 раз слабее по сравнению с их силой взаимодействия в кристалле. Если в растворе, приготовленном с одинаковой концентрацией, в качестве среды берется вода, то степень диссоциации бывает сравнительно больше по отношению к растворителям.
Концентрация раствора электролита. При уменьшении концентрации раствора (т.е. разбавлении раствора), вероятность встречи ионов уменьшается и равновесие смещается в сторону ионизации (степень диссоциации повышается). При уменьшении числа столкновений между ионами в разбавленных растворах в заметной степени снижается и скорость образования молекул. Это, в свою очередь, способствует смещению равновесия в сторону диссоциации и повышению степени диссоциации. Значит, степень диссоциации находится в обратной зависимости от концентрации электролита.
Влияние температуры
В процессе диссоциации электролитов в небольшом количестве поглощается или выделяется тепло. Обычно нагревание раствора на IoC усиливает процесс диссоциации большинства электролитов на 0,05%. При повышении температуры усиливается и электрическая проводимость электролита. Однако это связано как с понижением степени гидратации ионов и вязкости среды, так и с повышением скорости движения ионов. В этом отношении вода занимает особое место. Диссоциация воды эндотермический процесс, который протекает с затратой 57,3 кДж теплоты. Вот почему с повышением температуры повышается и степень диссоциации воды. При нагревании раствора сильных электролитов степень диссоциации понижается, а при нагревании слабых электролитов степень диссоциации повышается.
Влияние концентрации ионов. Повышением или понижением концентрации ионов, образованных в результате диссоциации, можно сместить равновесие. Например, NH4OH диссоциирует на ионы в воде по следующему
уравнению:
NH4OH
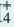
При добавлении в раствор немного NH4CI концентрация иона NH 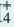
Постоянная диссоциации (Кд). Поскольку значение степени диссоциации зависит от концентрации электролита использование 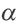
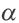
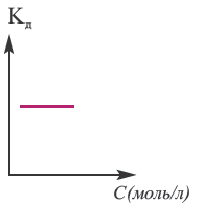
Постоянная диссоциации равна отношению произведения концентраций ионов на концентрацию молекул, не разложившихся на ионы.
Например, формула вычисления постоянной диссоциации для уксусной кислоты следующая:
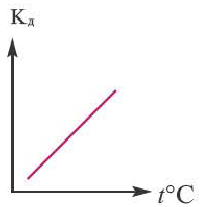
Поскольку Кд не зависит от концентрации, это постоянная величина. Значение Кд зависит от природы /электролита и растворителя и температуры. Чем больше значение Ka, тем больше диссоциирует электролит.
Электрическая проводимость бывает более высокой в том из растворов с одинаковым мольным количеством растворенных в них различных электролитов, в котором образуется наибольшее количество ионов. В ряду NaCl, FeCl2, AlCl3 в
водном растворе каждого из них электрическая проводимость повышается.
Диссоциация кислот, оснований и солей
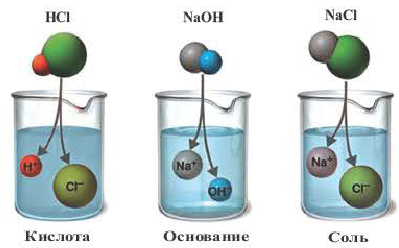
Все растворимые кислоты в водных растворах диссоциируют на ионы водорода и кислотных остатков. C точки зрения теории электролитической диссоциации кислотам можно дать такое определение:
Кислоты это сложные вещества, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода.
Диссоциация кислот
Свойства кислот (кислый вкус, воздействие на индикаторы и т.д.) связаны с наличием в растворе гидратированных ионов водорода (Н3О + ). Следовательно, общим для кислот является ион водорода H+ (или Н3О + ). Отсюда становится ясно, что цвет индикатора меняет ион H+ (или Н3О + ).
Одноосновные кислоты диссоциируют одноступенчато, двухосновные кислоты двуступенчато, а трехосновные кислоты (Н3РО4) грехступенчаго. Диссоциация двух- и трехосновных кислот в основном происходит в первой стадии (ступени). При ступенчатой диссоциации каждая последующая ступень протекает более слабо (т.е. при ступенчатой диссоциации процесс диссоциации протекает все медленнее). Основность кислот определяется количеством катионов водорода, образованных в процессе полной диссоциации.
| Диссоциация одноосновных кислот | Диссоциация двухосновных кислот | Диссоциация трехосновных кислот |
I. H2SO4  H + + H HSO H + + H HSO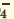 II. HSO4  H + + SO H + + SO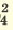 | I. H3PO4 H + +H2PO H + +H2PO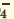 II. H2PO4  H + +HPO H + +HPO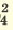 III.HPO 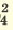  H+HPO H+HPO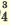 | |
I. H3PO3  H + + H2PO H + + H2PO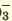 II. H2PO 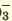  H + + HPО H + + HPО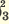 |
Знак обратимости  в процессе диссоциации указывает, что образовавшиеся ионы могут соединяться и образовывать исходные вещества и одновременно исходные ионы второй (или третьей) ступени. в процессе диссоциации указывает, что образовавшиеся ионы могут соединяться и образовывать исходные вещества и одновременно исходные ионы второй (или третьей) ступени. Если скорость распада на ионы больше, чем скорость образования исходных ионов, процесс диссоциации смещается вправо, если меньше то влево. |
Диссоциация оснований
Электролиты, при диссоциации которых в качестве анионов образуются только гидроксоионы, называются основаниями.
Растворимые в воде основания называют щелочами. Как известно, кислотность оснований определяется количеством гидроксильных ионов (ОН ) в их молекуле. Количество гидроксильных групп показывает кислотность основания. Однокислотные щелочи диссоциируют одноступенчато, двукислотные щелочи двуступенчаго. Цвет индикагора также меняется под действием гидроксильного иона (ОН ).
| Диссоциация однокислотных щелочей | Диссоциация двукислотных щелочей |
NaOH  Na + + ОН Na + + ОН KOH  K + + ОН K + + ОН NH4OH  NH NH 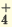 + ОН + ОН | I. Ca(OH)2 CaOH + + ОН CaOH + + ОН II. CaOH +  Ca 2+ + ОН Ca 2+ + ОН |
2OH + Zn 2+ 
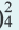
Диссоциация солей
Вещества, образующие в процессе диссоциации катион металла (или аммония) и анион кислотного остатка, называются солями.
В зависимости от вида, соли диссоциируют по-разному. Нормальные, двойные и смешанные соли диссоциируют одноступенчато.
Кислые соли диссоциируют ступенчато. Гидросоли диссоциируют двуступенчато, а дигидросоли трехступенчаго. Процесс диссоциации постепенно, поступенчато, слабеет.
| Диссоциация гидросолей | Диссоциация дигидросолей |
I. NaHSO4  Na + + HSO Na + + HSO II. HSO   H + + SO H + + SO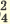 | I. KH2PO4  K + + H2PO K + + H2PO II. H2PO   H + + PO H + + PO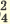 III. HPO 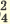  H + + PO H + + PO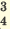 |
Основные соли также диссоциируют ступенчато: гидроксосоли диссоциируют двуступенчато, дигидроксосоли трехступенчато.
Реакции ионного обмена
Реакции обмена, протекающие между водными растворами электролитов, в прошлых разделах мы показывали молекулярными уравнениями. В действительности же, в этих реакциях участвуют не молекулы электролитов, а их диссоциированные ионы.
Взаимодействие водных растворов электролитов называют ионными реакциями, а уравнения таких реакций ионными уравнениями. Уравнение, полученное при сокращении ионов, не участвующих в реакции, называется сокращенным ионным уравнением.
Чтобы понять условия протекания реакций ионного обмена, нужно знать их важнейшие свойства.
Свойства ионов
Вам уже известно, что ионы отличаются от атомов строением и свойствами. Некоторые ионы бесцветны, а другие имеют определенный цвет. Для каждого из них характерны специфические химические свойства.
При составлении ионных уравнений соблюдаются следующие правила:
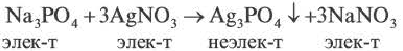
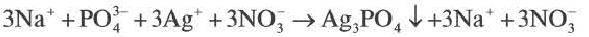
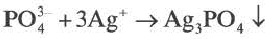
Если при реакциях заряды ионов не меняются, такие реакции называются реакциями ионного обмена.
Реакции ионного обмена протекают до конца в трех случаях:
Если образуется осадок.
BaCI2 + Na2SO4 = BaSO4↓ + 2NaCI
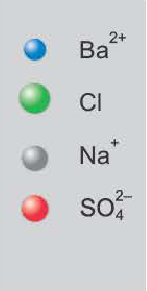
Ba 2+ +2CI + 2Na + +SO 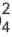
Ba 2+ +SO 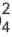
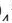
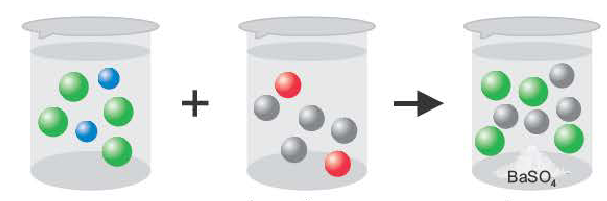
Если получается слабодиссоциирующее вещество (например: вода)
H + +CI +Na + +OH = Na + + Cl + H2O
H + +ОН =H2O
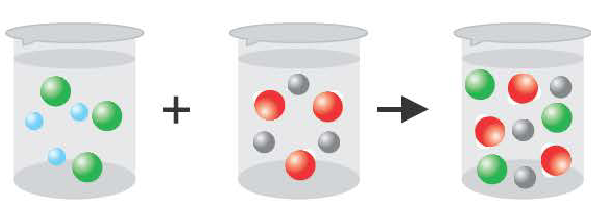
Если получается газообразное вещество.

2H + +2CI + 2Na + +S 2 = H2S↑ + 2Na + + 2CI
2H + +S 2 =H2S↑
Полное ионное уравнение и сокращенное ионное уравнение реакций, протекающих с участием или с образованием двух и более неэлектролитов, бывают одинаковыми.
Реакции ионного обмена используются для определения того или иного вещества или иона.
Обменные реакции в растворах электролитов протекают только тогда, когда хотя бы одно из образованных в результате этих реакций веществ является малодиссоциирующим, или нерастворимым (осадком), или же находится в газообразном состоянии.
Сумма коэффициентов сокращенного ионного уравнения реакций, протекающих с образованием лишь одного неэлектролита (осадка или мало диссоциирующего вещества) всегда на 1 единицу бывает больше суммы ионов, образующих этот неэлектролит.
| Слабые электролиты и неэлектролиты | Сумма коэффиниентов сокращенного ионного уравнения его образования |
| СаСО3, MgCO3, ВаСО3, CaSO4, BaSO4, PbSO4, SrSO4, ZnCO3, CuS, PbS, ZnS, CdS, AgCl, Н2О, HCOOH, CH3COOH и др. | 3 |
| Be(OH)2, Mg(OH)2, Zn(OH)2, Fe(OH)2, Cr(OH)2, Cu(OH)2, PbCl2, Mn(OH)2, MgF2 и др. | 4 |
| Al(OH)3, Fe(OH)3, Cr(OH)3, Ag3PO4 и др. | 5 |
| Ca3(PO4)2, Ba3(PO4)2 и др. | 6 |
| Соли, находящиеся в виде осадка, не вступают в реакцию с щелочами, основания в виде осадка не вступают в реакцию с солями, соли в виде осадка не вступают в реакцию с другими солями. |
Электролиз
Электролиз это окислительно-восстановительные реакции, протекающие на электродах, если через раствор или расплав электролита пропускают постоянный электрический ток. В результате электролиза электрическая энергия превращается в химическую энергию. При пропускании через электролитический раствор или расплав постоянного электрического тока хаотическое движение ионов урегулируется, катионы (положительно заряженные ионы) движутся в сторону катода, а анионы (отрицательно заряженные ионы) в сторону анода и, теряя заряды, превращаются в нейтральные атомы или молекулы. В результате на катоде протекает процесс восстановления, а на аноде процесс окисления. В процессе электролиза между участками катода и анода существуют перегородки.
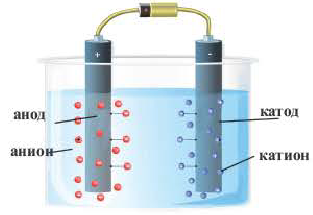
Электролизная ванна
Электролиз расплавов электролитов. Если через расплавы электролитов пропустить постоянный электрический ток, то происходит электролиз. При электролизе расплавов на катоде всегда восстанавливается катион, а на аноде окисляется анион. При электролизе расплавов любых солей, кроме солей аммония, на катоде всегда образуется металл. Рассмотрим процесс электролиза расплавленного хлорида натрия NaCl и гидроксида натрия (NaOH).

Электролиз расплава хлорида натрия
На катоде: Na + + е → Na° восстановление
На аноде: Cl е → Cl° окисление
2Na + +2Cl 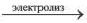
2NaCl 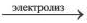

Электролиз расплава гидроксида натрия
Электролиз расплавов солей кислородсодержащих кислот в школьном курсе не изучается.
Электролиз водных растворов электролитов
При электролизе растворов электролитов характер происходящих на электродах электрохимических процессов зависит от природы иона, растворителя, концентрации электролита, материала, из которого изготовлен электрод, температуры, напряжения тока и других факторов. Для того, чтобы заранее определить на основе формулы солей, какие вещества будут образованы на электродах при электролизе водных растворов солей, следует знать следующие правила.
1. При электролизе растворов солей металлов, расположенных в электрохимическом ряду напряжения металлов начиная слития, включая алюминий (Li, К., Ca, Na, Mg, Al), на катоде молекулы воды восстанавливаются с выделением водорода.
На катоде: 2H2O + 2e → H2↑ +2ОН
2. При электролизе же растворов солей бескислородных кислот (НО, HBr, HI, H2S) этих металлов кислотный остаток на аноде окисляется с получением многоатомного простого вещества, и в растворе образуется основание, т.е. масса соли уменьшается.
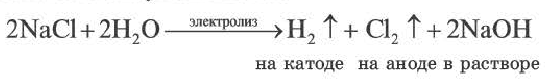
При электролизе растворов солей кислородсодержащих кислот этих металлов (Li, Na, К, Ca, Ba, Mg, Al) вода на аноде окисляется с выделением кислорода (О2), на катоде вода восстанавливается с выделением водорода. Масса соли не изменяется. Поскольку при электролизе растворов этих солей соль не разлагается, концентрация раствора повышается.
Na2SO4 +2H2O
При электролизе водных растворов щелочей LiOH, NaOH, KOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 происходит такой же процесс. Т.е. на катоде вода восстанавливается а на аноде вода окисляется.
NaOH + 2H2O 
3. При электролизе растворов солей металлов, расположенных в ряду напряжения металлов между алюминием и водородом (Mn, Zn1 Cr, Fe, Ni,Sn, Pb), на катоде ионы металла вместе с молекулами воды восстанавливаются с выделением металла и водорода. На аноде вода окисляется, выделяется кислород. (Электролиз растворов бескислородных солей этих металлов в школьном курсе не изучается).
| На катоде: | 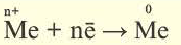 2H2O + 2ё → H2 ↑ +2OН |
| На аноде: | 2H2O 4ё → О2 ↑ + 4Н + |
| Общее уравнение | NiSO4 + 2H2O  Ni + H2 ↑ + O2 ↑ + H2SO4 Ni + H2 ↑ + O2 ↑ + H2SO4 |
4. При электролизе растворов солей металлов, расположенных в электрохимическом ряду напряжения металлов после водорода (Cu, Hg1 Ag, Pt, Au), на катоде восстанавливаются только ионы металла с получением металла. Из этих металлов при электролизе растворов солей бескислородных кислот меди Cu на аноде кислотный остаток окисляется, получается соответствующее простое вещество. Масса воды не меняется. Следовательно, при электролизе как расплавов, так и растворов CuCh, CuBr2, CuI2, на электродах всегда получается один и тот же продукт (на катоде металл, на аноде галоген).
5. При электролизе растворов солей кислородсодержащих кислот этих металлов (например, Cu(NO2)2, CuSO4, AgNО3, Hg(NO3)2) вода на аноде окисляется с выделением кислорода (O2), в растворе образуется кислота. Значит, при элекгролизе растворов солей этих металлов соль всегда подвергается разложению, концентрация соли уменьшается. 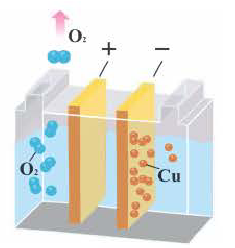
Электролиз водного раствора CuSO4
2CuSO4 + 2H2O 
4AgNO3 + 2H2O
При электролизе как расплавов, так и растворов солей бескислородных кислот (НС1, HBr, HI, H2S) на аноде кислотные остатки, окисляясь, превращаются в соответствующие простые вещества. Последовательность окисления кислогных остатков на аноде представлена в следующем виде:
При проведении электролиза раствора смеси нескольких солей, в первую очередь, на аноде выделится S, при отсутствии этого элемента l2, при его отсутствии Вr2, при его отсутствии С12, при его отсутствии О2.
При электролизе растворов солей HF (MeFa) на аноде ионы F не окисляются, окислению подвергаются молекулы воды. Значит, процесс окисления 2F 2e → F2 в водном растворе не происходит. Процесс окисления возможен лишь при электролизе расплава.
При электролизе водных растворов солей кислородсодержащих кислот (HNO3, H2SO4, H3PO4, Н2СО3 и др.) на аноде окисляется не кислотный остаток, а вода с выделением кислорода (O2).
При электролизе растворов смеси солей различных металлов первоочередная последовательность восстановления металлов на катоде следующая:
Факторы, влияющие на процесс электролиза. Процесс электролиза связан с электропроводной способностью растворов. Способность растворов к электрической проводимости зависит, в первую очередь, от концентрации ионов. Чем больше концентрация ионов, тем сильнее электропроводность раствора. Например, среди растворов солей KCl, Ba(NO3)2, А1С13 с концентрацией в 1 моль/л (т.е. 1 М) каждой из них (при одинаковой а) наибольшая электрическая проводимость будет у А1С13. Это обусловлено тем, что раствор этой соли обладает как наибольшим количеством ионов, так и более высокой концентрацией.
Применение электролиза. Электролиз применяется при получении активных металлов (Na, К, Ca, Mg, Al), меди (Сu), некоторых неметаллов (Cl2, F2) и щелочей (NaOH, КОН). Электролизом также пользуются для покрытия поверхности металлических предметов никелем, хромом, цинком, оловом, золотом и другими стойкими против коррозии металлами.
Гидролиз
Несмотря на отсутствие ионов H + и ОН в составе нормальных солей, их водные растворы показывают щелочную, кислую или нейтральную реакцию. Эта особенность водных растворов солей объясняется гидролизом hidro вода, Iizis разложение).
Реакции, протекающие с образованием слабых электролитов в результате взаимодействия ионов соли и молекул воды, называются гидролизом солей. Другими словами, гидролизом называют разложение солей под воздействием воды.
В зависимости от природы солей, они подвергаются или не подвергаются гидролизу. Если хотя бы одна из кислот или оснований, образующих соль, будет слабой, то такая соль подвергается гидролизу. Нерастворимые в воде соли гидролизу не подвергаются.
Так как гидролиз является обратимым процессом, в системе образуется динамическое равновесие. Гидролиз солей, образованных из многоосновных кислот или многокислотных оснований, протекает ступенчато. Гидролизные реакции записываются как в виде молекулярного, так и в виде ионного уравнений.
Для составления краткого ионного уравнения гидролиза следует:
По наличию или отсутствию процесса гидролиза соли подразделяются на четыре группы:
При гидролизе реакция среды определяется природой соответствующих кислоты и основания, образующих соль, иными словами, соотношением концентраций ионов H + и ОН.
При N(H + ) N(ОH ) среда бывает нейтральной; при N(H + )
Рассмотрим отдельно гидролиз группы солей, указанных выше.
2. Соли, образованные сильными кислотами и слабыми основаниями (Mex(SO4)y; MeXn);
X 

Me(NO3)n Me 
Определим ступени гидролиза Al(NO3)3.
I. Al(NO3)3 + H2O
Al 3+ + 3NO

AP + + H2O
II. Al(OH)(NO3)2 + H2O 
(AlOH) 2+ + 2NO 


(AlOH) 2+ + H2O (A1(OH )2) + + H +
III. Al(OH)2NO3 + H2O 
(Al(OH)2) + + NO3 + H2O 

A1(OH)2) + + H2O 
Таким образом, гидролиз солей, образованных много кислотными основаниями, протекает ступенчато. Так как в результате скопления ионов H + равновесие смещается влево, II и III ступени протекают очень слабо.
Из этого примера можно сделать такой вывод, что при гидролизе солей, образованных слабыми основаниями и сильными кислотами, гидролиз обуславливается каnионом (вот почему гидролиз таких солей называют гидролизом по катиону), среда реакции бывает кислой, лакмус окрашивается в красный цвет.
Если валентность металла и кислотного остатка равна двум, то на первой ступени гидролиза таких солей получается основная соль, число ступеней гидролиза равно валентности кислотного остатка.
I ступень. 2CuSO4 + 2H2O 
II ступень. (CuOH)2SO4 + 2H2O 
3. Соли, образованные сильными основаниями и слабыми кислотами (Na3PO3, K3PO4, HCOONa, HCOOK, CH3COOK, Na2CO3, K2CO3, Na2S, K2S, Na2SiO3, K2SiO3 и др.), подвергаются гидролизу, при этом среда показывает щелочную реакцию, лакмус окрашивается в синий цвет. Если валентность катиона меньше валентности аниона, то гидролиз соли протекает ступенчато (гидролиз в основном протекает на 1-ой ступени). Если валентность металла меньше валентности кислотного остатка, на 1-ой ступени гидролиза всегда получается кислая соль, число гидролизных ступеней бывает равным валентности кислотного остатка.
C увеличением концентрации скопившихся ионов ОН равновесие смещается влево. Поэтому гидролиз протекает только на 1-ой ступени.
4. Соли, образованные слабыми основаниями и слабыми кислотами ((NH4)2S, (NH4)2CO3, HCOONH4, CH3COONH4, Al2S3, Cr2S3), легче подвергаются гидролизу, среда реакции в основном нейтральная, цвет лакмуса (фиолетовый) не меняется. Так как при гидролизе этого типа солей гидролиз обуславливается как катионом, так и анионом, вид гидролиза определяется как по катиону, так и по аниону. Иногда при гидролизе такого типа солей реакция среды зависит от величины константы диссоциации кислоты и основания, полученных в результате диссоциации.
Так как гидролиз является обратимым процессом, то если исключить полученные продукты из среды реакции, т.е. при образовании нерастворимых в воде основания и кислоты, гидролиз протекает до конца.
Al2S3+ 6H2O 
Cr2S3 +6H2O 
Факторы, влияющие на гидролиз
Влияние температуры:
Усиление гидролиза при нагревании раствора нормальной соли объясняется возрастанием диссоциации воды, являющейся эндотермическим процессом.
Наоборот, при охлаждении раствора соли гидролиз ослабевает.
Влияние концентрации раствора:
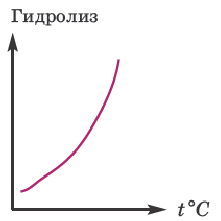
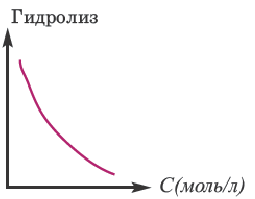
При увеличении концентрации раствора соли (т.е. при добавлении одной и той же соли) гидролиз ослабевает.
Значит, для усиления гидролиза нормальной соли одновременно следует уменьшить концентрацию раствора (путем добавления воды) и увеличить температуру. Эти последовательности выражены посредством представленных графиков.
Для ослабления или предотвращения гидролиза следует добавить в раствор вещество или же той же соли, создающих среду. Если при гидролизе соли среда кислая, то при добавлении в раствор кислоты, создающей эту среду, гидролиз ослабевает. Точно так же, если среда основная, то добавлением в раствор этой же щелочи можно ослабить гидролиз. Например, для ослабления гидролиза Na2CO3 в раствор следует добавить создающую среду NaOH, при гидролизе AI2(SO4)3 добавить создающую среду H2SO4 или соответствующую соль.
Растворы солей, подвергающихся гидролизу, нельзя хранить в посуде, изготовленной из амфотерных металлов (Be, Zn и Al). Потому что, независимо от того, кислая это или щелочная среда, эти металлы (Be, Zn, Al), будучи амфотерными, вступят в реакцию с веществом, создающим среду.
Водный раствор любой соли нельзя хранить в посуде, изготовленной из металла, более активного по сравнению с ее катионом. Потому что металл, из которого изготовлена посуда, вытеснит катион соли.
В ряду электрохимической напряженности металлов начиная с Mg, каждый металл вытесняет следующие после него металлы из водного раствора их солей. Щелочные (Li, Na, К) и щелочноземельные металлы (Ca, Sr, Ba) не вытесняют ни один металл из водного раствора их солей, так как они, в первую очередь, вступая в реакцию с водой, выделяют Н2.
Степень гидролиза. Для количественной характеристики гидролиза солей используют понятие степень гидролиза (αг).
Степень гидролиза (αг) равна отношению числа подвергнутых гидролизу молекул (nг) к их исходному числу (Nг), то есть:
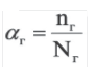
По мере повышения температуры степень гидролиза возрастает. Причиной этого является усиление диссоциации воды под действием температуры. Если в кислую среду, образованную в результате гидролиза, добавить кислоту, а в основную среду добавить щелочь, степень гидролиза уменьшится.
Гидратная теория
Представления о процессе электролитической диссоциации в дальнейшем были развиты в трудах русских ученых Ивана Алексеевича Каблукова и Владимира Александровича Кистяковского. Чтобы понять сущность представлений этих ученых, хотя бы вкратце рассмотрим явления, которые происходят при растворении веществ в воде.
При растворении в воде твердого гидроксида калия KOH или концентрированной серной кислоты H2SO4 происходит явление сильного разогревания. Необходимо осторожно растворять серную кислоту, так как из-за повышения температуры часть воды испаряется и под давлением пара может выбросить кислоту из сосуда. Чтобы этого избежать, серную кислоту тонкой струей наливают в воду (но не наоборот) при постоянном помешивании.
Если растворять аммонийную селитру (нитрат аммония) (NH4NO3) в тонкостенном стакане, поставленном на мокрую дощечку, то наблюдается столь сильное охлаждение, что стакан даже примерзает к ней. Почему при растворении веществ в воде в одних случаях наблюдается процесс разогревания, а в других охлаждения? При растворении твердых веществ происходит явление разрушения их кристаллических решеток и распределения образующихся частиц между молекулами растворителя. При этом необходимая энергия поглощается извне. Значит, разрушение кристаллических решеток твердых веществ (солей, щелочей) при их растворении в воде эндотермический процесс. Почему же при растворении некоторых веществ раствор разогревается?
Как вам известно, выделение теплоты это один из признаков химической реакции. Следовательно, при растворении происходит и химическая реакция. Например, молекулы серной кислоты реагируют с молекулами воды и образуются соединения состава H2SO4 ∙ Н2О (моногидрат серной кислоты) и H2SO4∙ 2Н2О (дигидрат серной кислоты). Иными словами, молекула серной кислоты присоединяет одну или две молекулы воды. Взаимодействие молекул серной кислоты с молекулами воды относится к реакциям гидратации, а вещества, которые при этом образуются, называются гидратами. Процесс же гидратации является экзотермическим.
При выпаривании раствора вещество (щелочи, соли) обычно выделяется в виде кристаллов, содержащих химически связанную воду. Например, если к сульфату меди (II) (порошок белого цвета) прилить воду, то происходит процесс разогревания и получается раствор голубого цвета. При выпаривании воды выделяется кристаллическое вещество голубого цвета медный купорос, имеющий состав CuSO4∙ 5Н2О.
При прокаливании медного купороса (кристаллогидрат сульфата меди(II) происходит выделение (дегидратация) воды.
Кристаллические вещества, в состав которых входит химически связанная вода, называются кристаллогидратами, а воду, входящую в состав кристаллов, называют кристаллизационной водой.
| Кристаллогидраты | Гидраты | |||||||
| FeSO4∙ 7H2O железный купороса SO4∙ 2Н2О природный гипс Na2CO3 ∙ 10H2O кристаллическая сода Na2SO4 ∙ 10H2O глауберова соль MgSO4 ∙ 7H2O горькая соль CuSO4 ∙ 5H2O медный купорос (синий камень) |
| Атом натрия | Ион натрия |
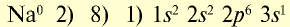 | 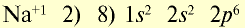 |
| Атом хлора | Ион хлора |
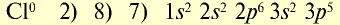 | 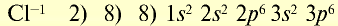 |
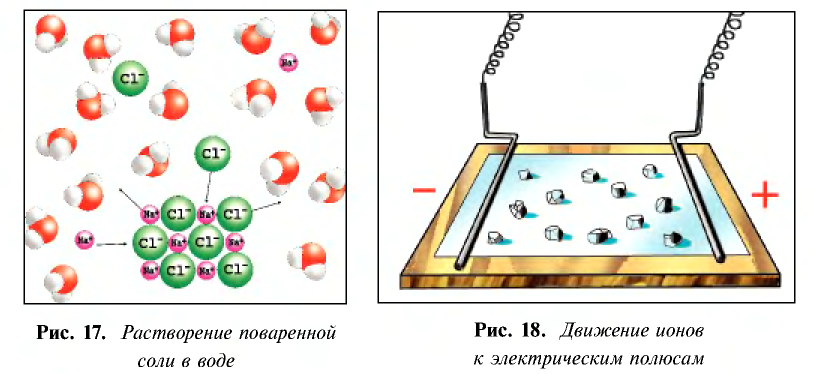
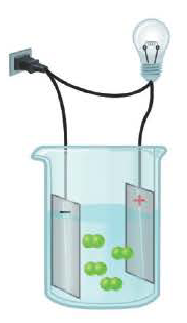
Распад на ионы соединений с ионной связью при образовании водных растворов называется диссоциацией. Этот процесс можно объяснить следующим образом. Вы уже знаете, что поваренная соль в твердом состоянии не пропускает электрический ток. При растворении в воде она разделяется на ионы, так как:
Таким образом, при растворении в воде кристаллы поваренной соли под воздействием поляризованных молекул воды образуют гидра-тированные ионы.
Атомы водорода и металлов превращаются в катионы, отдавая электроны, а атомы аммиака — присоединяя протоны за счет электронной пары, не участвующей в образований химической связи (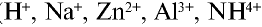
Кислотные остатки и гидроксильные группы являются анионами. В электрическом поле движение ионов происходит следующим образом (см. рис. 18).
Положительно заряженные ионы притягиваются катодом. Поэтому их называют катионами.
Отрицательно заряженные ионы притягиваются анодом, поэтому их называют анионами.
Соли и щелочи при плавлении также делятся на ионы за счет усиления колебательных движений частиц, приводящих к ослаблению связей между ними.
Кислоты представляют собой сильно поляризованные молекулы и при растворении в воде тоже распадаются на ионы, но этот процесс происходит у них иначе, чем у солей и щелочей:
При растворении хлорида водорода в воде атом водорода отдает электрон и переходит в молекулу воды. В результате образуется ион хлора с одним лишним электроном и ион Н30+ (гидроксония) с одним присоединенным протоном (ядро атома водорода). Следовательно, при растворении в воде НС1, 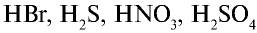
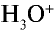
Изучая донорно-акцепторную связь, вы узнали, что 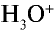
Уравнение диссоциации кислот обычно записывают в более кратком виде.
Элементы знаний, умений и навыков: элекролитическая диссоциация, теория электролитической диссоциации, катионы, анионы, ионы, ионная кристаллическая решетка, гидроксоний.
Диссоциация кислот, щелочей и солей
При диссоциации каких веществ образуются только ионы водорода?
Кислоты
Все кислоты, растворимые в воде, диссоциируют. При их диссоциации образуются ионы водорода и кислотный остаток:
Диссоциация многоосновных кислот протекает в несколько этапов:
Общие свойства кислот — кислый вкус, изменение цвета индикатора, способность вступать в реакцию с основаниями, основными оксидами и солями — объясняются образованием ионов водорода при их диссоциации. Исходя из этого можно дать следующее определение кислотам.
— Кислотами называются сложные вещества, при диссоциации которых в качестве катиона образуются только ионы водорода.
Основания
При диссоциации всех водорастворимых оснований выделяются катионы металла (ион гидроксида аммония 
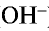
Все свойства, присущие водорастворимым основаниям — изменение цвета индикатора, способность вступать в реакцию с кислотами, кислотными оксидами и солями,— зависят от ионов 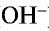
— Основаниями называются сложные вещества, при диссоциации которых в качестве аниона образуются только ионы гидроксида (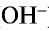
Соли
При диссоциации солей образуются катионы металла (в аммониевых солях катион 
Кислые соли диссоциируют, помимо ионов металла, на ионы водорода:
При диссоциации солей не образуются общие для всех солей ионы, поэтому они не имеют общих свойств.
— Солями называются сложные вещества, при диссоциации которых наряду с катионами металла образуются анионы кислотного остатка (а в кислых солях и катионы водорода).
Элементы знаний, умений и навыков: кислоты, щелочи и соли с точки зрения теории электролитической диссоциации. Многостадийная диссоциация.
Сильные и слабые электролиты
Почему уксусная кислота считается слабым электролитом?
— Отношение числа диссоциированных молекул к исходному числу растворенных молекул называется степенью диссоциации электролита, которая обозначается буквой а:
Степень диссоциации выражается в долях единицы или в процентах.
Если степень диссоциации равна 0,5, то это значит, что каждая из двух молекул распалась на ионы. Если а — 1, то на ионы распались все молекулы. При выражении степени диссоциации в процентах ее значение определяется так: если из ста молекул распались на ионы 85, то а будет равна 85%. Степень диссоциации зависит от природы растворенного электролита и растворителя, концентрации раствора, температуры среды. Поэтому вместе со степенью диссоциации указываются концентрация раствора и температура. Например, степень диссоциации 0,05 М серной кислоты при 18°С составляет 58 %.
— Электролиты с относительно высокой степенью диссоциации называются сильными.
Они практически полностью диссоциируют в растворах любой концентрации. Большинство солей (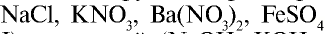
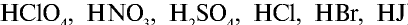
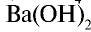
— Электролиты, степень диссоциации которых низка даже в разбавленных растворах, называются слабыми.
Все органические и некоторые неорганические кислоты (H2C03, НС10, H,S, HN02, H2C03, H2Si03, НС102 и др.), гидроксид аммония, нерастворимые гидроксиды металлов, вода считаются слабыми электролитами.
Таблица 19
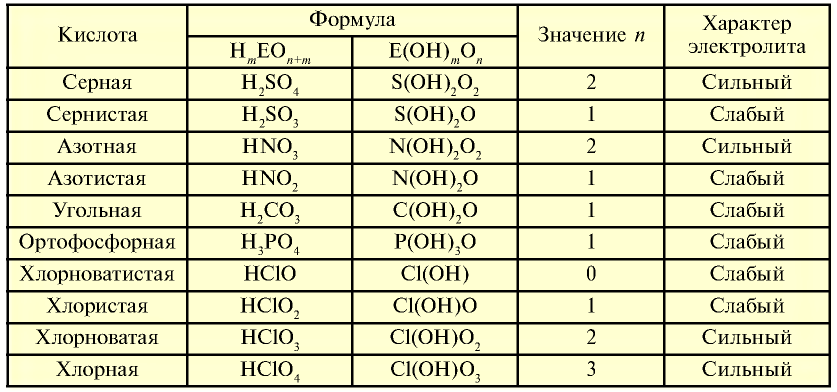
На основе общих формул кислородсодержащих кислот 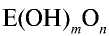
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
- Что влияет на степень диссоциации слабых электролитов
- Что влияет на степень общественной опасности деяния















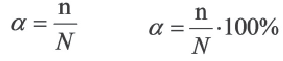
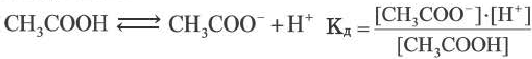
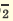

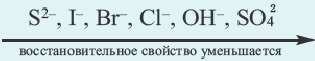
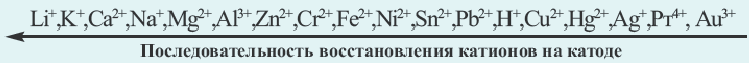
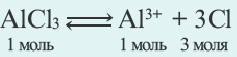
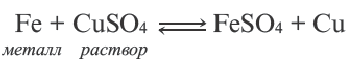
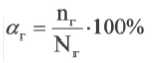
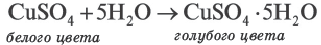
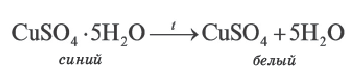
 ∙(n-1)H2O
∙(n-1)H2O