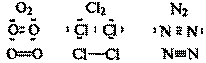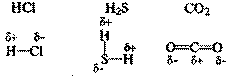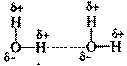чем больше разность электроотрицательностей между двумя атомами тем полярность связи
Типы химической связи. Электроотрицательность и степень окисления, полярность связей
Часть 1. Типы химической связи. Электроотрицательность и степень окисления, полярность связей.
Ковалентная связь – связь между двумя атомами, которые соединяются друг с другом за счет образования ОБЩЕЙ электронной пары.
Существует два возможных механизма образования общей электронной пары:
· обменный механизм, когда каждый из взаимодействующих атомов предоставляет в пару по одному электрону,
· донорно-акцепторный механизм, если один из атомов предоставляет электронную ПАРУ, а другой – пустую (вакантную) орбиталь.
‼ По донорно-акцепторному механизму образованы связи в следующих веществах:
1. Все комплексные соединения;
3. Азотная кислота, оксид азота (V), нитраты
Электроотрицательность (ЭО) – способность атома притягивать электроны при образовании химической связи. Таким образом, электрон сместится к атому того элемента, который имеет большую электроотрицательность.
Возможно три случая для двух атомов А и В, образующих связь: А — В
1) ЭО (А) = ЭО(В) (разность электроотрицательностей равна нулю).
Общая электронная пара не смещена ни к одному из атомов. Не возникает ПОЛЮСОВ, электронная плотность у обоих атомов одинакова.
Это НЕПОЛЯРНАЯ ковалентная связь.
‼Примеры неполярной ковалентной связи: а) двухатомные простые вещества: H–H, F–F,
б) симметричные молекулы типа Н2О2 ( Н-О-О-Н) – связь между двумя атомами кислорода и т. п.
При образовании ковалентной связи электронная пара смещена к более электроотрицательному атому А, на нём возникает частичный отрицательный заряд, а на В – частичный положительный.
Такая связь называется ковалентной ПОЛЯРНОЙ.
‼ Такой тип связи характерен для молекул (или частей молекул), состоящих из двух и более неметаллов (HCl, H2O, СН3СООН).
Чем больше разность ЭО, тем выше полярность связи (при этом электронная пара принадлежит обоим атомам). Например, в ряду НСl à HBr à HI полярность связи уменьшается.
Такая связь называется ИОННОЙ.
Ионная связь – предельный случай ковалентной полярной связи.
‼Такой тип связи характерен для соединений металлов с неметаллами, оксидов металлов, оснований и солей, в том числе солей органических и солей аммония.
В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака.
Ионная связь характеризуется ненаправленностью и ненасыщенностью. Вещества с ионной связью имеют ионную кристаллическую решетку.
‼Необходимо помнить, что существуют вещества, в молекуле которых одновременно присутствуют и ионные, и ковалентные связи (например, NaOH, KNO3).
Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние электроны. Поэтому эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. «Обобществленные» электроны передвигаются в пространстве между катионами металлов и удерживают их вместе.
Водородная связь – это связь не внутри молекулы, а между молекулами или между независимыми частями молекул.
Водородная связь – возникает между сильно электроотрицательными атомами (обычно водорода или фтора, реже азота) и атомом водорода другой молекулы или части молекулы:
(сплошной чертой обозначена ковалентная связь, точками – водородная связь).
Наличие водородных связей приводят к аномальному повышению температур кипения у веществ, в которых она присутствует.
Температуры кипения водородных соединений неметаллов VIА группы
tкип, oС −2 −42 −60 +100
Сильные водородные связи между молекулами воды препятствуют ее плавлению и испарению.
Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений, например, для салициловой кислоты.
Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца.
Уксусная, муравьиная и другие карбоновые кислоты и в жидком, и в газообразном состоянии существуют в виде димеров:
Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты.
Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
‼ Вещества, между молекулами которых есть водородные связи:
2. Фтороводород, раствор фтороводорода (плавиковая кислота).
3. Растворы аммиака NH3 и аминов – между азотом аммиака (амина) и атомами водорода воды.
4. Органические вещества, имеющие гидроксильную группу: спирты, фенолы, карбоновые кислоты.
5. Растворы углеводов – моносахаридов и дисахаридов.
ВАЛЕНТНОСТЬ – число связей, образованных данным атомом в данной молекуле.
Например, в молекуле SO3 у серы 6 связей, т. е. сера в этой молекуле имеет валентность VI.
Валентные возможности атомов – весь набор возможных валентностей.
Они определяются числом неспаренных электронов и возможных донорно-акцепторных связей (ДАС).
Высшая возможная валентность элементов (без учёта ДАС), как правило, равнa номеру группы. Это правило не выполняется:
А) у элементов второго периода, начиная с азота (у них отсутствуют d-орбитали и нет возможности для распаривания электронов)
Б) у элементов 8 группы (в главной подгруппе для гелия, неона и в побочной подгруппе для элементов триад)
В) у элементов 1 группы побочной подгруппы (у них высшая валентность больше номера группы).
Пример: у серы на третьем внешнем слое есть 6 электронов.
В невозбуждённом (основном) состоянии она имеет валентность II:
При переходе одного электрона на d – оболочку она становится четырёхвалентной:
Чем больше различие в электроотрицательности связываемых атомов, тем выше полярность связи



Неполярная ковалентная связь– связь между атомами с равной электроотрицательностью (и, следовательно, равномерным распределением электронной плотности между ядрами атомов
C-C; F-F; Cl-Cl; O=O; N≡N
Если ковалентная связь образуется между двумя одинаковыми атомами, она называется неполярной
Неполярными являются также связи между одинаковыми атомными группировками.
Например, связь C—C в молекуле H3C—CH3.
Полярная ковалентная связь – связь между атомами с различной электроотрицательностью (2 > Δχ > 0,5) и несимметричным распределением общей электронной пары.
Электронная плотность такой связи смещена в сторону более электроотрицательного атома.
Направление смещения электронов обозначается также стрелкой:
C→ Cl; C→ O; C→N;
Ионная связь— это электростатическое взаимодействие между ионами с зарядами противоположного знака.
Ионная связь образуется между атомами с сильно отличающейся электроотрицательностью. При этом один атом отдает электроны и превращается в положительно заряженный ион, а атом, получивший электроны, в отрицательно заряженный. Ионы удерживаются вместе за счет сил электростатического притяжения.
Водородная связь образуется между полярными молекулами (вода, спирты,аммиак) за счет притяжения разноименных зарядов.
Прочность водородной связи существенно (
20 раз) меньше, чем ионной или ковалентной связи.
В периодической системе элементы распределяются по группам согласно количеству валентных электронов, а в периоды их относят по количеству энергетических уровней.
Чем больше разность электроотрицательностей между двумя атомами тем полярность связи
§3.4. Электроотрицательность. Различие между полярной ковалентной и ионной связями.
Только о небольшой части всех химических связей можно сказать, что они являются чисто ковалентными. В таких соединениях поделенная пара электронов всегда находится на одинаковом расстоянии от ядер обоих атомов. Это возможно тогда, когда между собой связаны одинаковые атомы. Например, из рассмотренных нами в этой главе молекул чисто ковалентными окажутся двухатомные молекулы водорода, кислорода, хлора, азота:
Когда между собой связываются разные атомы, поделенная пара химической связи всегда смещена к одному из атомов. К какому? Разумеется, к тому атому, который проявляет более сильные акцепторные свойства.
Под электроотрицательностью (ЭО) понимают относительную способность атомов притягивать электроны при связывании с другими атомами. Электроотрицательность характеризует способность атома к поляризации химических связей.
Электроотрицательность зависит не только от расстояния между ядром и валентными электронами, но и от того, насколько валентная оболочка близка к завершенной. Атом с 7 электронами на внешней оболочке будет проявлять гораздо большую электроотрицательность, чем атом с 1 электроном.
Фтор является «чемпионом» электроотрицательности по двум причинам. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего одного электрона) и, во-вторых, эта валентная оболочка (. 2s 2 2p 5 ) расположена близко к ядру. Например, в соединении NaF поделенная электронная пара оттянута к атому фтора так сильно, что можно, почти не погрешив против истины, приписать фтору целый отрицательный, а натрию – целый положительный заряд:
Ионную связь можно рассматривать как предельный случай полярной ковалентной связи.
Внешне соединения с ионными и ковалентными связями могут довольно сильно отличаться друг от друга. Ионные соединения – обычно твердые и хрупкие вещества, плавящиеся при высоких температурах. Растворы ионных соединений проводят электрический ток, потому что при растворении они распадаются на заряженные ионы. Типичное ионное соединение – поваренная соль NaCl.
Соединения с ковалентными и полярными ковалентными связями в обычных условиях часто являются газами или жидкостями. Если это твердые вещества, то плавятся они достаточно легко, хотя есть и исключения, которые мы обсудим в §3.8. Растворы таких веществ далеко не всегда проводят электрический ток, потому что при растворении они могут и не распадаться на ионы. Типичные соединения с полярными ковалентными связями: хлороводород HCl, углекислый газ СО2, вода Н2О, песок SiO2, многочисленные органические соединения.
На примере родственных соединений HCl и NaCl можно видеть, как увеличение полярности связи может в итоге приводить к качественным изменениям в свойствах веществ при одинаковых условиях (рис. 3-4).
Рис. 3-4. Хлороводород HCl (содержит полярную ковалентную связь) при комнатной температуре – газообразное вещество. В этих же условиях поваренная соль NaCl (ионная связь между атомами) – твердое кристаллическое вещество.
Иногда встречается утверждение, что ионная связь – это химическая связь, возникающая в результате кулоновского притяжения противоположно заряженных ионов. Действительно, электростатическое притяжение противоположных зарядов в ионных соединениях вносит заметный вклад в энергию связи. Но в то же время ковалентная составляющая химической связи никогда не выключается полностью даже в наиболее ионных соединениях.
Можно ли измерить степень полярности ковалентной связи? Где кончается полярная ковалентная связь и начинается ионная?
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом. Электроотрицательность ( X ) измеряется в относительных величинах (таблица 3-3).
Таблица 3-3. Электроотрицательности ( X ) некоторых элементов.
Данные из справочника: CRS Handbook of Chemistry and Physics (издание 2007 года).
Электроотрицательнось по Полингу – это свойство атомов, связанных химическими связями, т.е. находящихся в составе химических соединений. Соединения таких благородных элементов, как гелий, неон и аргон до сих пор не получены, поэтому не определена и ЭО этих элементов. Однако в полной таблице в приложении VII уже можно найти значения для ксенона (Xe), соединения которого с фтором и кислородом известны с 60-х годов ХХ века.
Для фтора во многих книгах приводится значение X = 4,0 и в этом нет ошибки. Просто в таблице 3-3 приведены уточненные данные и, кроме того, значение 3,98 вполне может быть округлено до 4,0.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов Li, Na, Mg и т.д. И это понятно – ведь их внешние электронные оболочки далеки от завершения и для них выгоднее сдвинуть свои валентные электроны к чужому атому, чем «добирать» электроны у соседей.
Обратите внимание на необычно высокую электроотрицательность атома водорода ( X = 2,20) – она значительно выше значений для щелочных металлов. В этом нет ничего удивительного: атом водорода лишь формально является электронным аналогом атомов щелочных металлов – на самом деле ему не хватает только одного электрона для полного завершения своей валентной оболочки (как и атомам галогенов с их высокими значениями X ). Поэтому электроноакцепторные свойства атома водорода выражены сильнее, чем у щелочных металлов.
Допустим, между двумя какими-то элементами образовалась химическая связь. Теперь разность электроотрицательностей этих элементов (Δ X ) позволит нам судить о том, насколько эта связь отличается от чисто ковалентной.
Какие бы два атома не были связаны между собой, для вычисления Δ X нужно из большей электроотрицательности вычесть меньшую.
Таким образом, при возникновении химической связи происходит не только обобществление электронов, но и в ряде случаев передача электронов от одного атома другому. Эта передача может быть частичной или почти полной. Электроны всегда передаются от атома с меньшей электроотрицательностью атому с большей электроотрицательностью.
3.14. Определите характер связи в приведенных ниже соединениях и разделите их на три группы: а) соединения с ковалентными связями, б) с полярными ковалентными связями, в) с ионными связями. Решение обоснуйте.
3.15. В таблице 3-3 в тексте параграфа не приведены электроотрицательности для благородных газов. Попробуйте предсказать значение электроотрицательности ксенона в соединении XeF 6 (речь идет о качественной оценке: “больше чем у фтора”, “меньше чем у фтора”). Проверьте свое предположение по таблице электроотрицательностей элементов в приложении. Предложите свое объяснение экспериментальным фактам.
Электроотрицательность. Виды химических связей
Начнем с того, почему вообще важна электроотрицательность. Все химические связи образуются за счет нее. В зависимости от того, какие атомы вступают в образование химической связи, она делится на определенные виды. Поэтому для того, чтобы понять суть этого деления, нам нужно разобраться:
Для того чтобы понять это, нам понадобится понятие атомного остова из прошлой статьи.
Электроотрицательность
Электроотрицательность — это способность атома оттягивать на себя электроны с внешнего электронного слоя.
Да-да, ЕГЭ вы сдали хорошо — электроотрицательность увеличивается слева направо и сверху вниз, но почему? Выделим две причины, но для второй нам потребуется немного физики. Ну все, ты закрываешь статью и говоришь: «Какая физика?»
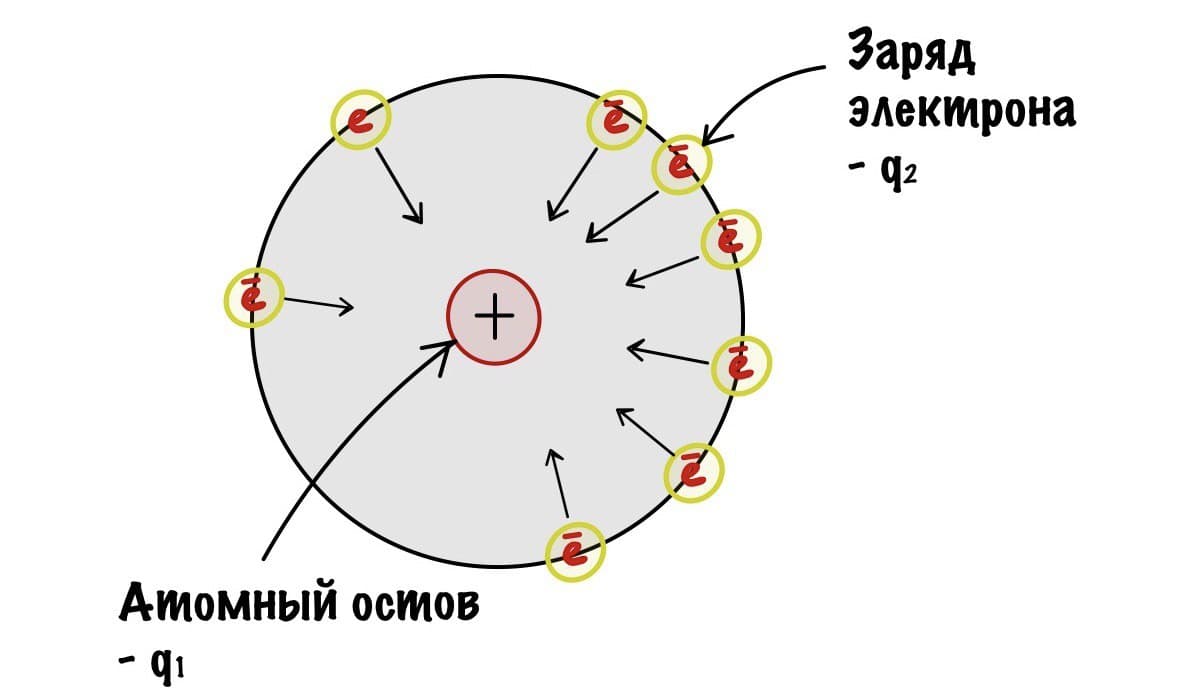
Так, начнем с закона Кулона — он показывает силу взаимодействия между двумя электрическими зарядами. Наши заряды разноименные. Атомный остов — положительный, а электрон — отрицательный. Значит они притягиваются друг к другу.
Сразу скажу, что ничего считать мы не будем. Коэффициент — k нас не интересует. Нам просто нужно понять, что чем больше q1 и q2, тем больше сила притяжения между зарядами. Радиус, как я писал до этого, примерно одинаковый в одном периоде. Теперь мы можем сравнить электроотрицательность атомов второго периода с помощью небольшого рисунка. Для этого мы предположим, что электроны находятся примерно на одном расстоянии атомного остова.
Получается, что q1 — это заряд атомного остова, а q2 — заряд электрона, который всегда одинаковый. Вот мы и нашли легкую зависимость — чем больше заряд атомного остова, тем с большей силой он притягивает электрон, и тем больше электроотрицательность. У кислорода заряд ядерного остова 6, а у азота только 5. Самый большой заряд у фтора — 7. С увеличением периода возрастает радиус атома — электроотрицательность становится меньше. Получается, что максимальная электроотрицательность у элементов второго периода и растет она слева направо, так как увеличивается заряд атомного остова.. Хоть мы это и знали, но прикольно же понять почему такое происходит?
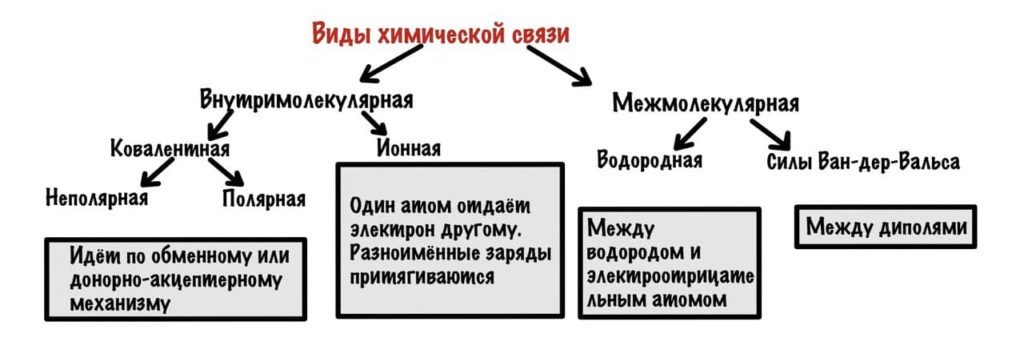
Виды химических связей
Напишу про все, кроме металлической связи, она не особо интересует нас в биохимии. Химическая связь нужна для того, чтобы придать дополнительную стабильность системе. Что за система? Ну это просто атомы, которые вступают в образование связей — при образовании связи энергия системы уменьшается, и она становится стабильнее, а значит стабильнее и состояние атома.
Можно разделить химические связи на две группы: внутримолекулярные и межмолекулярные. Начнем с внутримолекулярных.
Внутримолекулярные химические связи
Всего два варианта: ионная и ковалентная. Правда последняя делится на две, но разберемся с этим в процессе.
Ковалентная химическая связь
Она возникает, если атомы образуют общие электронные пары. Может идти по двум механизмам: обменному и донорно-акцептерному.
Обменный механизм
У атомов на внешнем слое есть неспаренные электроны. Они решают поделиться ими с другими атомами и образовать связь.
Донорно-акцепторный механизм
У одного атома есть неподеленная электронная пара — два электрона на одной орбитали, а у другого есть пустая орбиталь. Если первый атом очень щедрый, то он может отдать свой электрон другому атому и образовать связь. Так образуются ионы аммония и гидроксония — аммиак и вода присоединяют протон водорода (у него нет электрона).
Ну это все понятно, но для чего нужна была электроотрицательность? А вот для чего — ковалентная связь бывает неполярной и полярной.
Ковалентная неполярная химическая связь
Здесь в образовании связи участвуют два атома с одинаковой электроотрицательностью, например — два водорода, два кислорода и так далее.
Нам подойдет один из прошлых рисунков с образованием водорода. Так как электроотрицательность у атомов одинаковая, то общая электронная пара не смещается к какому-либо атому, а лежит посерединке.
Ковалентная полярная химическая связь
После образования связи атом кислорода начинает тянуть электронную пару на себя. Она проводит больше времени с его стороны, так как у электронов отрицательный заряд, то и заряд на кислороде становится частично отрицательным — δ-заряд. Можно нарисовать это попроще.
Мы можем сделать вывод, что чем больше разность электроотрицательности у атомов, тем больше полярность связи. Если возьмем какой-нибудь оксид азота, то кислород будет меньше оттягивать на себя электроны, так как электроотрицательность у них не слишком различается. А это значит, что и дельта заряд на кислороде и азоте будет меньше.
Но если мы возьмем молекулу воды, то разница в электроотрицательности кислорода и водорода большая. Значит дельта заряды и полярность связи будут побольше
Полярность молекулы
Раз уж мы здесь, то давайте сразу определимся от чего зависит полярность молекулы. Это важно для понимания того, какие молекулы свободно пройдут через биологическую мембрану, а какие нет. Полярность молекулы зависит от полярности связей между атомами и геометрии молекулы. Если все связи в молекуле неполярные, то и молекула неполярная, например O2. Такие молекулы легко проходят через мембрану.
Посложнее с полярными связями. Здесь все зависит от геометрии молекулы. Геометрия молекулы может быть симметричной — у нее нет неподеленных электронных пар и неспаренных электронов, например CO2. Значит CO2 тоже легко пройдет через мембрану.
Но если у молекулы есть неподеленные электронные пары или неспаренные электроны, то она асимметрична. Значит она полярна, например H2O и NH3.
Такие молекулы будут хуже проходить через мембрану. Вода транспортируется через специальные белки — поры (аквапорины). Кстати, возможно аквапорины еще нужны потому, что вода в растворе переходит в ион гидроксония. Ион гидроксония — это полярная и заряженная молекула, которая практически не будет проходить через мембрану.
Ионная связь
Она образуется в случае, когда разница в электроотрицательности между двумя атомами просто огромная! Мы знаем, что атомы стараются полностью заполнить свои энергетические слои. Как это можно сделать? Можно отдать лишний электрон или присоединить электрон к себе. Когда два таких атома встречаются, то один из них отдает электроны, а другой принимает — отдает обычно щелочной/щелочно-земельный металл или водород. В итоге один атом становится заряжен отрицательно — анион, а другой положительно — катион. Они удерживаются друг с другом благодаря силам электростатического взаимодействия — разноименные заряды притягиваются. Да, да, я опять пишу эту банальщину.
Или вот ионная связь между молекулами аминокислот.
Сведем все в табличку.
Межмолекулярные химические связи
Здесь взаимодействуют не атомы, а молекулы. Капитан очевидность. В таких связях очень маленькое количество энергии, но их настолько много, что они придают стабильность большим системам — белок, ДНК. Два варианта — водородные связи и и силы Ван-дер-Ваальса.
Водородная связь
Водородная связь — это связь атома водорода одной молекулы с атомом другой молекулы. Звучит просто, но она может образоваться не всегда. Есть условия, о которых мы сейчас поговорим:
С помощью водородных связей образуются вторичная структура белка и вторичная структура ДНК.
Основной вклад в образование таких связей вносит электростатическое взаимодействие. Еще пишут про донорно-акцепторный механизм, но если бы он тут был, то образовывались ионы гидроксония, мы уже разобрали это выше.
Силы Ван-дер-Ваальса
Там три варианта, но я остановлюсь только на двух — ориентационных и индукционных взаимодействиях. Сначала ориентационные, с ними полегче. Проще будет просто показать это.
Такие молекулы называют диполями — у них есть положительно и отрицательно заряженные части. Молекулы ориентируются друг на друга: положительные части располагаются рядом с отрицательными и между ними образуются слабые связи. Ну вы поняли, что такая тема может идти только в соединениях с ковалентной полярной связью.
Теперь индукционные. Смотрите, есть одна молекула — HCl, у нее есть дельта-положительно заряженный водород. Вдруг такая молекула подходит к молекуле, где связь неполярная, например водороду. Что было дальше? А вот что, дельта-положительный водород начинает оттягивать на себя электронную пару из молекулы. Тут то и образуется диполь.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.