частые рецидивы герпеса 2 типа что делать
Хронический рецидивирующий герпес (herpes chronicus recidivans)
Это наиболее частая форма эндогенной инфекции, вызываемой вирусом простого герпеса. Появляется в любом возрасте у людей, ранее инфицированных вирусом простого герпеса и имеющих противовирусные антитела. В патогенезе рецидивирующего герпеса основная роль принадлежит факторам, снижающим иммунитет: переохлаждение, вирусные инфекции, пневмония, хронические стрессы, тяжелые общие заболевания (лейкоз, рак и др.). У женщин обострение хронического герпеса часто связано с менструальным циклом.
Что провоцирует / Причины Хронического рецидивирующего герпеса (herpes chronicus recidivans):
К местным факторам, способствующим возникновению обострения, следует отнести травму слизистой оболочки рта, повышенную инсоляцию, высушивание красной каймы губ. Рецидивы могут возникать с различной частотой, в разное время года и не имеют сезонности. У некоторых больных рецидивы возникают 1-2 раза в год, у других 3-4 раза в месяц. В редких случаях заболевание приобретает перманентный характер, когда одни высыпания еще не разрешились, а другие уже появляются.
Симптомы Хронического рецидивирующего герпеса (herpes chronicus recidivans):
Диагностика Хронического рецидивирующего герпеса (herpes chronicus recidivans):
Хронический рецидивирующий герпес необходимо дифференцировать от:
Дифференциальная диагностика основывается на особенностях клинической картины хронического рецидивирующего герпеса, а также на данных цитологических исследований содержимого пузырьков и соскоба из области эрозий, образовавшихся после вскрытия пузырьков в первые 2-3 дня заболевания.
В препаратах обнаруживают гигантские многоядерные клетки. Применяют также вирусологический метод исследования.
Лечение Хронического рецидивирующего герпеса (herpes chronicus recidivans):
Противовирусные химиопрепараты назначают в первые часы и дни после появления высыпаний. Использование ацикловира по 0,2 г 5 раз в день в течение 5 дней при рецидивах хронического герпеса сокращает сроки обострения заболевания и уменьшает болезненные ощущения в областях поражения.
Назначают также бонафтон внутрь по 150 мг в сутки в течение 5-7 дней. Одновременно можно использовать 0,5 % бонафтоновую мазь.
Можно использовать и другие противовирусные препараты: алпизарин, риодоксол, хелепин, теброфен, флореналь, мегосин, метисазон.
Интерферон и его индукторы (госсипол, мегасин) применяют при рецидивах хронической герпетической инфекции. Наиболее эффективно их действие в продромальный период и при появлении первых признаков рецидивов. Хорошее интерфероногенное действие оказывает дибазол, который назначают по 0,01 г 2 раза в день в течение месяца.
Местно используют противовирусные мази с первых дней рецидива, лейкоцитарный интерферон, раствор которого в виде аппликаций наносят на область поражения 5-6 раз в день.
Эффективна лазерная терапия (гелийнеоновый, инфракрасный лазеры).
Внутрь обычно назначают большие дозы аскорбиновой кислоты.
Несколько меньший терапевтический эффект оказывает дезоксирибонуклеаза (ДНКаза), которую вводят внутримышечно по 10-25 мг, предварительно растворив порошок в дистиллированной воде или изотоническом растворе натрия хлорида. Инъекции делают через день; на курс 6-10 инъекций.
При нарушениях системы иммунитета эффективны курсы иммунокорригирующей терапии. Вводят Тактивин по 50 мкг подкожно через день, на курс 5-8 инъекций. Аналогичный препарат тимоптин вводят подкожно по 100 мкг, на курс 4-5 инъекций с интервалами между введениями 4 дня.
Левамизол (декарис) благоприятно действует на течение рецидивирующих форм простого герпеса, сокращая продолжительность рецидивов, удлиняя периоды ремиссии и уменьшая болезненность высыпаний. Назначают препарат по 50-150 мг в первые 3 дня каждой недели с перерывами между курсами 5-6 дней; всего 2-4 курса.
Необходимо тщательное обследование больных рецидивирующим герпесом для выявления и устранения очагов хронической инфекции в организме, в том числе и в полости рта (периодонтит, пародонтит, тонзиллит, гайморит и др.). Устраняют местные факторы, способствующие возникновению рецидивов (хроническая травма, сухость губ, хронические трещины губ).
К каким докторам следует обращаться если у Вас Хронический рецидивирующий герпес (herpes chronicus recidivans):
Актуальные вопросы тяжелой герпетической инфекции у взрослых
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная. Многие вопросы патогенеза и терапии тяжелого и крайне-тяжелого течения герпесвирусной инфекции по-прежнему не решены.
Вид ВПГ относится к семейству Herpesviridae, подсемейству L-Herpesviridae, виду ВПГ. Различают два основных типа вируса — ВПГ 1 и ВПГ 2. Инфицирование возможно как одним, так и двумя типами возбудителя. ВПГ способен внедряться в различные клетки организма человека: в клетки кожи, слизистых оболочек урогенитального и желудочно-кишечного трактов (ЖКТ), дыхательных путей, центральной и периферической нервной системы, печени, эндотелия сосудов, а также в клетки крови — лимфоциты и др. [1]. Место постоянного обитания (пожизненного персистирования) ВПГ — паравертебральные сенсорные ганглии. ВПГ передается прямым контактным путем, возможна передача возбудителя контактно-бытовым и вертикальным путем (от матери к плоду), а также трансфузионным и парентеральным путями через инструменты при оперативных вмешательствах, стоматологических процедурах и т. д.
Как известно, большинство людей инфицированы ВПГ. Первичный иммунный ответ на инфекцию протекает латентно или с герпетическими высыпаниями с местной и общей воспалительной реакцией. У лиц с нормальным иммунным ответом размножение (репликация) ВПГ находится под иммунологическим контролем, и рецидивы бывают крайне редко или не возникают в течение всей жизни. В противовирусной защите организма участвуют факторы неспецифической защиты, уничтожающие или блокирующие вирусы: макрофаги и другие клетки-продуценты интерферонов (ИФН) α, β и γ, ряд интерлейкинов (ИЛ) (фактор некроза опухоли (ФНО), ИЛ-6 и др.), естественные киллеры и факторы, формирующие специфический иммунный ответ против конкретного вируса: цитотоксические Т-лимфоциты (ЦТЛ) (CD 8+ Т-лимфоциты) и В-лимфоциты, ответственные за продукцию специфических антител, блокирующих репликацию вируса и расположенные вне клетки вирусы. Для адекватного функционирования этих клеток и поддержания иммунного ответа необходима соответствующая продукция ИФН и ИЛ.
Под влиянием различных экзогенных и эндогенных факторов, повреждающих иммунную систему, возможно ослабление контроля над репликацией вируса и соответственно развитие рецидива. Рецидив ВПГ-инфекции могут спровоцировать другие инфекционные заболевания, переохлаждение, чрезмерная инсоляция, психические или физические стрессы, интоксикации различного генеза, в том числе употребление алкоголя, циклические изменения гормонального статуса (менструации), особенно при дисбалансе уровня гормонов у женщин, резкая смена климатических поясов и др.
При длительной хронической инфекции вирусы оказывают многостороннее неблагоприятное действие на иммунную систему человека. ВПГ прямо повреждают клетки иммунной системы (лимфоциты, макрофаги и естественные киллеры). Синтезируя белки-супрессоры и химерные белки, вирусы угнетают многие реакции иммунитета: ВПГ могут блокировать действие ИФН, нарушать распознавания инфицированных клеток и другие защитные реакции. Кроме того, высокая мутационная активность вирусного генома также способствует ускользанию вируса от иммунологического контроля.
Хроническая, часто рецидивирующая ВПГ-инфекция может провоцировать развитие аутоиммунных состояний (антифосфолипидный синдром, аутоиммунный тиреоидит, аутоиммунные васкулиты и др.). Кроме того, при интеграции ВПГ в генетический аппарат клеток возможна неопластическая трансформация клеток. Так, ВПГ является одним из факторов повышенного риска развития рака тела и шейки матки и других онкологических заболеваний. Также ВПГ-инфекция является одной из ведущих причин самопроизвольных абортов, преждевременных родов, рождения детей с патологией центральной нервной системы и внутренних органов. ВПГИ ассоциирована со многими «болезнями цивилизации» — атеросклерозом, ишемической болезнью сердца у лиц моложе 50 лет и др. Тяжелое течение ВПГИ может быть маркером онкологических заболеваний и СПИДа [7].
В зависимости от числа и выраженности рецидивов, выделяют легкое, среднетяжелое и тяжелое течение болезни (табл. 1).
При тяжелом течении ВПГ-инфекции возможно одновременное появление нескольких очагов поражения (например, в области половых органов, губ, крыльев носа), а также последовательное возникновение высыпаний разной локализации (один рецидив на фоне другого), продолжительность обострения при этом может достигать 16–20 дней. В месте высыпания больные ощущают жар, жжение, боль, напряжение и/или зуд кожи. На инфильтрированной коже появляется группа пузырьков, заполненных прозрачным содержимым. Пузырьки могут сливаться в сплошной многокамерный элемент. Прозрачное их содержимое затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах ВПГ часто поражает одни и те же участки кожи. Как правило, при тяжелом течении инфекции значительно ухудшается физическое и психическое состояние больных. У части пациентов в период рецидива увеличиваются или появляются слабость, лихорадка, озноб, миалгии, цефалгии, артралгии, раздражительность, нарушение сна, эмоциональная лабильность, также могут развиваться тяжелые депрессивные состояния, требующие медикаментозной коррекции. По данным органов здравоохранения США, ВПГ-инфекция аногенитальной локализации является примерно в 10% случаев причиной депрессий и суицидов. Тяжелое течение генитальной формы ВПГ-инфекции с частыми рецидивами приводит к нарушению нормальной половой функции пациента, болезнь нередко создает конфликтные ситуации в семье, на работе. Лечение больных с тяжелым течением ВПГ-инфекции представляет собой сложную задачу и должно включать как медикаментозную терапию, так и психологическую адаптацию пациента.
У больных с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные средства, общеукрепляющие препараты). Как правило, такие больные меняют много лечебных учреждений в поисках адекватной помощи.
С течением заболевания появляется много побочных реакций на медикаменты или их непереносимость, в ряде случаев развивается устойчивость ВПГ к ацикловиру, ИФН a, другим средствам. Иммуностимуляторы, используемые эмпирически, могут приносить облегчение в период их приема, но во многих случаях они оказываются неэффективными и даже ухудшают клиническое течение болезни. Усугубляются проявления вторичного иммунодефицита, присоединяются другие инфекции, субдепрессивные состояния переходят в стойкие нарушения психики, теряется вера больных в выздоровление, в возможность современной медицины им помочь.
Для разработки современных подходов к лечению и контролю над ВПГ-инфекцией и более углубленного понимания патогенеза заболевания нами было изучено состояние различных звеньев противовирусной защиты и системы цитокинов у больных с тяжелым и крайне тяжелым течением ВПГ-инфекции аногенитальной и лабиальной локализации, а также степень инфицированности (системности заболевания) и частота сочетания с другими герпесвирусными инфекциями.
Обследовано 102 больных, страдающих тяжелой ВПГ-инфекцией более 2 лет (28 мужчин и 74 женщины, средний возраст — 34 ± 1,5 года) и имеющих частоту рецидивов более шести в год.
При этом у 60 больных наблюдалось от 6 до 11 рецидивов ВПГ-инфекции в год, а у 42 больных — от 12 до 20 рецидивов. У большинства пациентов преобладала аногенительная или смешанная локализация герпеса. Средняя длительность тяжелого течения заболевания составила 9,3 ± 1,2 года. Группу контроля составили 32 практически здоровых добровольца (14 мужчин и 18 женщин, средний возраст — 32 ± 1,6 года). Анализ ряда изучаемых параметров включал результаты обследования пациентов с легким течением заболевания (36 человек — 10 мужчин, 26 женщин, средний возраст — 33,4 ± 2,1 года, с частотой рецидивов 2,9 ± 0,8 в год). При рецидивах жалобы больных были характерными. Часто встречались депрессия, раздражительность, снижение памяти и другие нарушения физического и психического состояния и познавательных функций.
У многих больных в анамнезе были указания на повторные курсы противовирусной и/или иммунотропной терапии, оказывавшей неоднозначное влияние: или кратковременное положительное влияние на течение ВПГ-инфекции, или ухудшение и развитие рецидива на фоне или после отмены иммунокоррекции. Такие анамнестические данные отражают тяжесть иммунной недостаточности и неадекватность проводимой эмпирической терапии без оценки иммунного статуса и индивидуального подбора иммунокорректоров, а также восстановительной терапии — иммунореабилитации [5].
При обследовании больных с тяжелым течением ВПГ-инфекции выявлялись многие маркеры вторичного иммунодефицита в виде хронических инфекционно-воспалительных заболеваний различной локализации, со смешанным характером микрофлоры и в большинстве случаев ее устойчивостью к повторным курсам антибиотикотерапии. Из 102 больных хронической ВПГ-инфекцией тяжелого течения выявлены:
Эти данные свидетельствуют о необходимости комплексного подхода к лечению ВПГ-инфекции тяжелого течения с учетом осложнений вторичного иммунодефицита.
Кроме того, проводили ПЦР-исследование биологических материалов на наличие ДНК ВПГ 1 и 2 типа и других вирусов герпес-группы: цитомегаловируса, вируса герпеса человека (ВГЧ) 6 типа, вируса Эпштейна–Барр. Используемые нами программы амплификации позволяли выявлять ДНК вирусов на уровне, соответствующем активной их репликации. Наличие активной репликации вирусов подтверждали полуколичественным ПЦР-исследованием и серологическими тестами.
В результате исследования у больных с тяжелым течением ВПГ-инфекции обнаружены лабораторные признаки вторичного иммунодефицита.
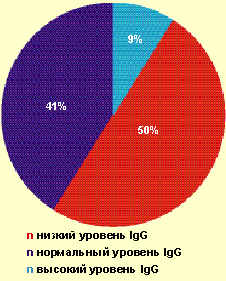 |
| Рисунок 1. Частота выявления различных значений IgG у больных с тяжелым течением ВПГ-инфекции |
Так, у большинства пациентов (91%) отсутствовало адекватное повышение продукции IgG в ответ на рецидив ВПГ-инфекции (рис. 1). При частоте рецидивов ВПГ-инфекции 6–11 рецидивов в год низкий уровень IgG выявлялся у 25% больных, при частоте — 12–20 рецидивов в месяц — уже у 64,3% больных. Более чем у 70% больных был повышен уровень ЦИК в 1,5–2,0 раза от показателей нормы. Известно, что длительная циркуляция ЦИК может приводить к отложению их на эндотелии сосудов и служить одним из факторов формирования аутоиммунной патологии.
У большинства больных с ВПГ-инфекцией тяжелого течения (70%) были обнаружены нарушения в системе естественной и/или специфической цитотоксичности (рис. 2) — снижение содержания зрелых активированных естественных киллеров CD16 + (менее 11%), Т-киллеров и/или ЦТЛ CD8 + (менее 27%). Важно отметить, что выраженное снижение уровня CD8 + (в состав которых входят также и супрессорные клетки) в большинстве случаев сочеталось с повышением уровня CD4 + и иммунорегуляторного индекса, что является фактором риска в отношении формирования аутоиммунных процессов. Как известно, системы естественной и специфической цитотоксичности играют ведущую роль в противовирусной защите.
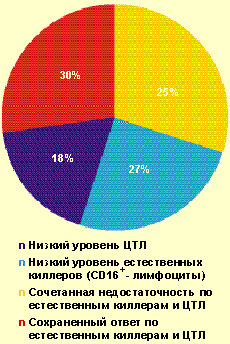 |
| Рисунок 2. Частота выявления нарушений в системе естественной и специфической цитотоксичности у больных с тяжелым течением ВПГ-инфекции (n = 102) |
Обнаруженные нарушения в системах цитотоксичности и их активационных маркерах при ВПГ-инфекции косвенно свидетельствуют о недостаточном уровне продукции Т-хелперами 1 типа ИЛ-2 — одного из важнейших звеньев цитокиновой сети, необходимого для полноценного противовирусного иммунного ответа.
При исследовании функционального состояния нейтрофилов у больных с тяжелым течением ВПГ-инфекции повышение спонтанного НСТ-теста было выявлено почти в половине случаев. Однако показатели стимулированного НСТ-теста и индекса стимуляции, напротив, были существенно снижены у большинства больных, что свидетельствует об истощении у них резервных способностей нейтрофилов.
Н. А. Дидковский, доктор медицинских наук, профессор
И. К. Малашенкова, кандидат медицинских наук
Ж. Ш. Сарсания, кандидат биологических наук
А. Н. Танасова, И. Н. Зуйкова, И. А. Зуйков, Н. М. Хитрик
НИИ физико-химической медицины, ММА им. И. М. Сеченова, Москва
Частые рецидивы герпеса 2 типа что делать
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478; ФГБУ «Московский государственный медико-стоматологический университет им. А.И. Евдокимова», Москва, Россия, 127473
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478
Рецидивирующая герпес-вирусная инфекция: стратегия противовирусной терапии
Журнал: Клиническая дерматология и венерология. 2015;14(3): 29-36
Шульженко А. Е., Зуйкова И. Н., Щубелко Р. В. Рецидивирующая герпес-вирусная инфекция: стратегия противовирусной терапии. Клиническая дерматология и венерология. 2015;14(3):29-36.
Shul’zhenko A E, Zuykova I N, Shchubelko R V. Recurrent herpes virus infection: the strategy of antiviral therapy. Klinicheskaya Dermatologiya i Venerologiya. 2015;14(3):29-36.
https://doi.org/10.17116/klinderma201514329-36
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478; ФГБУ «Московский государственный медико-стоматологический университет им. А.И. Евдокимова», Москва, Россия, 127473
Генитальная форма герпес-вирусной инфекции широко распространена и встречается во всех популяционных группах. Самая высокая заболеваемость зарегистрирована у лиц в репродуктивном возрасте, что в значительной мере влияет на материнскую заболеваемость, рождаемость, перинатальные потери и на здоровье нации в целом. Цель исследования — изучение клинической эффективности Валвира (генерического валацикловира компании «Actavis») в терапии генитальной формы хронической рецидивирующей герпесвирусной инфекции (ХРГВИ). Материал и методы. В 2014 г. в клинике Института иммунологии Федерального медико-биологического агентства России проведено сравнительное исследование клинической эффективности препарата Валвир в лечениии иммунокомпетентных пациентов с генитальной формой ХРГВИ. Пациентам основной группы (20 мужчин и женщин) был назначен препарат валацикловир (Валвир), больным группы сравнения (20 человек) — Ацикловир (производство России). Результаты. На фоне 5-дневного курса терапии Валвиром в дозе по 500 мг 2 раза в сутки у пациентов с генитальной формой ХРГВИ отмечено сокращение длительности течения рецидива и ускорение реэпителизации (в среднем с 6,4 сут до лечения до 3,8 сут на фоне терапии), эффективное купирование местных симптомов рецидива (до 2,5±0,3 сут) и сокращение периода начала эпителизации герпетических повреждений (до 1,9 сут) по сравнению с контрольной группой, получавшей ацикловир. Выводы. Валвир — препарат с доказанной клинической эффективностью в отношении генитальной формы ХРГВИ. Показано сокращение продолжительности местных симптомов рецидива и периода реэпителизации. Препарат Валвир обладает хорошей переносимостью и безопасностью как у молодых пациентов, так и пациентов старшего возраста.
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478; ФГБУ «Московский государственный медико-стоматологический университет им. А.И. Евдокимова», Москва, Россия, 127473
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478
Спектр клинических проявлений герпес-вирусной инфекции (ГВИ) отличается значительным разнообразием. Они зависят от локализации патологического процесса, его распространенности, состояния противовирусного звена иммунного ответа. Вирусы простого герпеса 1-го и 2-го типов наиболее часто поражают кожные покровы, слизистые оболочки, центральную нервную систему. Кроме того, клинические проявления ГВИ определяют:
1) особенности вируса простого герпеса (ВПГ): его типа, антигенности и вирулентности;
2) локализацию поражения (тканевое или органное);
3) стадию и фазу заболевания (обострение или ремиссии);
4) тяжесть течения и длительность инфекционного процесса;
5) пол, возраст и степень иммунокомпетентности пациента;
6) проводимую терапию.
Одна из наиболее распространенных локализаций поражения ВПГ — урогенитальный тракт. Генитальный герпес встречается во всех популяционных группах, и самая высокая заболеваемость зарегистрирована в возрасте 20—29 лет, а второй пик приходится на возраст 35—40 лет [1—3].
ВПГ проникает в организм через кожу или слизистые оболочки путем прямого контакта с естественными барьерами и/или биологическими жидкостями инфицированного человека. Показано, что заражение может происходить от инфицированного пациента вне зависимости от наличия или отсутствия симптомов заболевания. Только 10—25% серопозитивных по отношению к ВПГ людей имеют анамнез генитального герпеса, что предполагает наличие у большинства людей нераспознанной атипичной или бессимптомно протекающей инфекции. В 70% случаев инфицирование генитальным герпесом происходит при контакте с партнером, имеющим бессимптомную форму ГВИ [1, 3].
Существует несколько классификаций ГВИ, которые отражают различные варианты течения и формы заболевания. Все они учитывают основные виды клинических проявлений генитального герпеса (Н.В. Шперлинг и соавт., 2010) [4]:
— легкое течение — частота рецидивов 1—2 раза в год, ремиссия не менее 6 мес;
— средней степени тяжести — частота рецидивов 3—5 раз в год, ремиссия не менее 3 мес;
— тяжелое течение — частота рецидивов более 6 раз в год, ремиссия от нескольких дней до 6 нед;
При первичном инфицировании поражения часто имеют множественную локализацию, сопровождаются увеличением и болезненностью паховых лимфатических узлов. Следует отметить, что первый клинический эпизод генитального герпеса является истинным проявлением первичной ГВИ, если пациент ранее никогда не отмечал у себя симптомов заболевания, а в его крови отсутствуют антитела к ВПГ. Инкубационный период первичного герпеса половых органов колеблется от 2 до 12 дней (в среднем 6 дней). Типичная картина проявлений генитального герпеса характеризуется появлением на слизистых оболочках половых органов и прилежащих участках кожи единичных или множественных везикулезных элементов, возникающих на эритематозном фоне. Через 1—2 дня везикулы вскрываются, образуя мокнущие эрозии, реже язвочки, эпителизирующиеся под коркой или без ее образования. У людей обоих полов первичная атака обычно протекает тяжело, с выраженными симптомами общей интоксикации: у большинства пациентов отмечается лихорадка, недомогание, чувство ломоты в мышцах, головная боль. Вирусные частицы выделяются из инфицированных тканей 10—12 дней. Длительность острого периода при первичном генитальном герпесе может достигать 10 дней. Однако в большинстве случаев инфицирование протекает скрытно, переходя сразу в латентный период [1, 3, 5].
Типичные поражения у мужчин располагаются на коже лобковой области, теле полового члена или в перианальной области. Реже высыпания появляются на головке полового члена, венечной борозде, мошонке, в промежности, на бедрах или ягодицах. Герпетические поражения у женщин могут находиться на половых губах, коже промежности, перианальной и ягодичной областей. При присоединении вторичной бактериальной инфекции возможны поражения шейки матки в виде диффузного воспаления с эрозиями, больших изолированных язв и иногда тяжелых некротических изъязвлений.
У большинства женщин и мужчин при первичном генитальном герпесе возникают дизурические расстройства. Сильная боль и деструкция тканей могут вызвать задержку мочи (синдром Элеберга) [3, 5].
Помимо описанного, к первичному эпизоду относят те случаи заболевания, при которых первые клинические проявления развиваются на фоне серопозитивности к ВПГ-инфекции. Симптоматика при этом, как правило, менее интенсивна, чем при истинном первичном герпесе, но более выражена, чем при рецидивирующей форме болезни [3].
Вторичная герпес-вирусная инфекция встречается у больных любого возраста, перенесших первичный герпес. Реактивация ВПГ происходит обычно в первые несколько месяцев после первичного эпизода заболевания. Проявления рецидива генитального герпеса могут быть различными: от бессимптомного выделения вируса или легких симптомов до очень болезненных сливных изъязвлений с четкими границами. В большинстве случаев рецидивирующего генитального герпеса клинические симптомы последующих обострений менее тяжелые и продолжительные по сравнению с первичным эпизодом. Продромальная фаза, включающая зуд, жжение или кожную гиперчувствительность в местах последующих поражений, наблюдается приблизительно у половины больных с рецидивирующим герпесом половых органов. Частота рецидивов у мужчин и женщин, как правило, одинакова, однако их проявления различны. У мужчин рецидивы длятся дольше и характеризуются наличием большего числа очагов поражения, чем у женщин, в то время как у женщин клиническая симптоматика более острая, чем у мужчин [1, 3].
С увеличением длительности заболевания и под воздействием местной терапии клиническая картина генитального герпеса часто изменяется. Высыпания в очаге поражения могут миновать отдельные стадии развития. Сохраняются лишь эрозии, папулезные элементы и отечные пятна на фоне эритемы. При атипичных формах генитального герпеса характерные очаги поражения на слизистых оболочках и коже гениталий могут отсутствовать, отмечаются лишь гиперемия и диффузный отек слизистой, редко возникают рецидивирующие болезненные трещины. Описана также рецидивирующая форма генитального герпеса, для которой характерен лишь зуд, а в ряде случаев субъективные ощущения отсутствуют.
Распространена также бессимптомная форма генитального герпеса (60% от всех случаев), которая характеризуется реактивацией ВПГ без развития классических симптомов заболевания. Важно, что именно больные с бессимптомным генитальным герпесом чаще всего становятся источником инфицирования для своих половых партнеров [1, 3, 5].
При рецидиве ГВИ во время беременности риск передачи вируса новорожденному и развития заболевания невелик. Первичный же эпизод генитального герпеса у беременной может стать причиной трансплацентарной передачи вируса плоду, при этом исход первичной ГВИ во многом определяется сроком гестации, на котором произошло инфицирование [2].
Частые рецидивы, вызывающие дискомфорт в области половых органов, небольшая эффективность многих назначенных схем лечения нередко приводят к значительному ухудшению физического и психического состояния пациентов. У больных генитальным герпесом нередко отмечают депрессию, гневливость, уменьшение чувства собственного достоинства и враждебность к человеку, послужившему вероятным источником заражения. Таким образом, у пациентов с генитальным герпесом отмечается рост психосексуальных и социальных психических расстройств [3].
Задачами лечения рецидивирующей ГВИ являются сокращение частоты обострений, уменьшение их выраженности и длительности, улучшение качества жизни пациентов, а также предупреждение инфицирования половых партнеров и новорожденного.
Основным направлением в лечении является применение высокоспецифичных противовирусных препаратов — ациклических нуклеозидов, которые блокируют репликацию ВПГ. В настоящее время, согласно международным стандартам лечения герпес-вирусных инфекций, препаратами выбора являются ацикловир, валацикловир и фамцикловир [6—8].
Ацикловир — первый противовирусный препарат системного действия — проявляет свою активность против клеток, пораженных ВПГ. Поскольку ацикловир является аналогом 2’-деоксигуанозина, для функционирования ему необходима активация клеточной тимидинкиназой, измененной вирусом, с последующим его превращением в ацикловир-трифосфат. Такая форма ацикловира необратимо, конкурентно с деоксигуанозинтрифосфатом, ингибирует ДНК-полимеразу вируса, что предотвращает возможность элонгации цепи вирусной ДНК. Отсутствие в здоровой клетке специфических изменений, вызванных ферментом вируса, превращающим исходную форму ацикловира в ацикловир-трифосфат, обусловливает специфичность действия ацикловира.
К сожалению, при высокой избирательности действия ацикловира его биодоступность при пероральном приеме остается весьма низкой. В связи с этим для достижения желаемого эффекта в клинической практике зачастую приходится назначать достаточно высокие дозы данного препарата. Именно поэтому пероральное использование ацикловира ограничено при лечении тяжелых стадий заболеваний, вызванных вирусами герпеса.
В отличие от противовирусного препарата первого поколения ацикловира, валацикловир имеет исключительно высокую биодоступность, превышающую аналогичный параметр ацикловира в 3—5 раз. Кроме того, даже при пероральном применении средства его уровень в плазме крови достигает высоких величин, сравнимых со значениями, полученными при введении ацикловира в вену. Такое свойство валацикловира обусловлено его химической структурой. Ее уникальность заключается в том, что валацикловир представляет собой соединение L-валина и ацикловира эфирной связью. Эта особенность позволяет доставлять проацикловир в неизмененном виде в плазму крови. Метаболизируясь в печени гидролазой, валацикловир распадается на валин и ацикловир, который в свою очередь уже обладает антивирусным эффектом. Кроме того, некоторая часть валацикловира гидролизуется в тонком кишечнике с высвобождением активной формы ацикловира. Особенности фармакокинетики данного препарата позволяют назначать его вне зависимости от приема пищи.
Выделяют два основных способа применения противовирусных химиопрепаратов: эпизодическое назначение (по мере необходимости, при обострениях ГВИ) и пролонгированная терапия. В первом случае препарат назначают коротким курсом в течение 5—10 дней, во втором пациенты принимают препарат ежедневно в течение нескольких месяцев или лет, не только для купирования данного рецидива, но и для профилактики последующих обострений [7—9].
Эпизодическая терапия предпочтительна для пациентов, имеющих слабо выраженные и редкие обострения инфекционного заболевания. Целью лечения в этом случае является уменьшение выраженности симптомов рецидива. Для наибольшей эффективности прием препарата необходимо начинать во время продромального периода или 1-х суток клинических проявлений. Согласно Российским клиническим рекомендациям, при рецидивах генитального герпеса назначают ацикловир по 200 мг 5 раз в день (или по 400 мг 3 раза в день) в течение 5 дней, или валацикловир 500 мг 2 раза в день в течение 5 дней, или фамцикловир по 125 мг 2 раза в день в течение 5 дней [6] (табл. 1).

Своевременный прием ациклических нуклеозидов позволяет прервать репликацию вируса, и в таком случае рецидив протекает в абортивной форме. Для своевременного начала приема препаратов пациентам рекомендовано всегда иметь при себе небольшое количество таблеток ациклических нуклеозидов, а в случае рецидива, на стадии предвестников заболевания, принять препарат.
Для пациентов с частотой рецидивов более 6 раз в год рекомендована пролонгированная схема приема противовирусных препаратов. По данным литературы, она эффективна у 70—80% пациентов. Для такой терапии обязательным является индивидуализированный подход, который включает оценку частоты, тяжести обострений у данного пациента, а также его индивидуальные потребности в контроле рецидивов заболевания [7—9].
Супрессивная терапия предпочтительна в случаях частого рецидивирования генитального герпеса, особенно при тяжелом течении обострений. Также подчеркивается целесообразность использования супрессивной схемы лечения при выраженных эмоциональных реакциях пациента на возобновление симптомов заболевания. Применяемые дозировки при использовании супрессивной схемы лечения зависят от клинического течения рецидивов генитального герпеса. В случае, если у пациента с данным заболеванием количество рецидивов не превышает 10 раз в год, суточная доза валацикловира должна составлять 500 мг. При количестве рецидивов более 10 в год используется суточная дозировка валацикловира 1000 мг [7—9].
Преимущества применения валацикловира:
— в отличие от других противовирусных препаратов валацикловир не приостанавливает, а блокирует размножение вируса простого герпеса;
— меньшее количество приема таблеток в сутки улучшает комплаентность терапии у пациента и уменьшает риск пропуска приема препарата, а значит, повышает эффективность лечения и снижает лекарственную нагрузку на организм;
— валацикловир сочетается с большинством лекарственных средств, не влияет на память, внимание и скорость реакции;
— не обладает тератогенными и мутагенными эффектами.
В последнее время на российском рынке появляется большое количество препаратов валацикловира. Одним из таких средств является европейский аналог валациловира компании «Actavis» — Валвир. Форма выпуска — таблетки, покрытые пленочной оболочкой, в стандартной дозе 500 мг (валацикловира гидрохлорида гидрат 611, 70 мг), а также в дозе 1000 мг (валацикловира гидрохлорида гидрат 1223, 40 мг). Для изучения препарата проведено исследование его клинической эффективности у пациентов с хронической рецидивирующей герпесвирусной инфекцией (ХРГВИ).
Материал и методы
Исследование проводилось у пациентов, обратившихся в клинику Института иммунологии Федерального медико-биологического агентства России в 2014 г. В основную группу вошли иммунокомпетентные пациенты (без установленного первичного иммунодефицита и ВИЧ-инфекции), мужчины и женщины старше 18 лет с клинической картиной обострения генитальной герпетической инфекции. Критериями исключения были: беременность, лактация, применение другой противовирусной или иммунотропной терапии, наличие декомпенсированных заболеваний или острых состояний, способных существенно повлиять на результат исследования.
На визите скрининга специалисты собирали анамнез заболевания, отмечая частоту и продолжительность обострений инфекции, ранее применяемое лечение. Всем пациентам были даны рекомендации по своевременному началу приема препарата валацикловир (Валвир) в течение первых 6 ч от момента появления симптомов обострения или в период продромальных симптомов.
В процессе наблюдения за пациентами, получавшими терапию в момент обострения генитального герпеса, обращали внимание на длительность и выраженность местных симптомов (зуд, боль, жжение в месте поражения), характер элементов высыпаний, площадь поражения, сроки заживления и продолжительность симптомов интоксикации.
Выраженность субъективных симптомов (зуд, боль, жжение) во время обострения оценивали в баллах по следующей шкале: 0 баллов — отсутствие жалоб, 1 балл — незначительные ощущения зуда, жжения или боли в месте высыпаний, не мешающие повседневной жизни, 2 балла — умеренно выраженные симптомы, создающие ежедневный дискомфорт, 3 балла — жалобы на выраженные субъективные ощущения в области высыпаний с иррадиацией в другие анатомические области (бедра, крестец, промежность и т. д.).
Пациенты основной группы (20 мужчин и женщин с генитальной ХРГВИ) получали препарат валацикловир (Валвир) по схеме 500 мг 2 раза в сутки в течение 5 дней. Для оценки эффективности и безопасности терапии пациентов осматривали в клинике на 1-е, 3-и, 5-е сутки лечения, а также через 14 дней после завершения терапии. В случае появления новых высыпаний пациент являлся в клинику на незапланированный визит. В группу сравнения вошли 20 пациентов, получавших терапию ацикловиром (производство Россия) по стандартной схеме — 400 мг 3 раза в сутки в течение 5 дней.
Всем пациентам во время каждого визита проводили объективное обследование, включающее регистрацию следующих параметров: локализация очага поражения; площадь очага поражения (см 2 ); характеристика элементов высыпаний с указанием времени появления (гиперемия, везикулы, эрозии, начало эпителизации, полная реэпителизация).
Оценку эффективности исследуемого препарата проводили на основании следующих критериев:
— уменьшение степени тяжести клинического течения рецидива;
— время продолжительности местных симптомов (зуд, боль, жжение в области поражения);
— время, необходимое для начала эпителизации;
— время достижения полного выздоровления (полная эпителизация).
Кроме объективных данных, эффективность терапии оценивали согласно субъективным ощущениям пациента в баллах: 5 баллов — очень хорошая; 4 балла — хорошая; 3 балла — удовлетворительная; 2 балла — неудовлетворительная; 1 балл — крайне неудовлетворительная.
Побочные реакции от приема препарата оценивали согласно объективным данным и субъективным ощущениям пациента. Выраженность побочных реакций исследуемого препарата оценивали по следующей шкале в баллах: 5 баллов — не отмечается побочных эффектов; 4 балла — наблюдаются незначительные побочные эффекты, не причиняющие серьезных проблем пациенту и не требующие отмены препарата; 3 балла — отмечаются побочные эффекты, оказывающие влияние на состояние пациента, но не требующие отмены препарата; 2 балла — имеет место нежелательный побочный эффект, оказывающий значительное отрицательное влияние на состояние пациента, требующий отмены препарата; 1 балл — побочный эффект, требующий отмены препарата и применения дополнительных медицинских мероприятий.
Переносимость препарата оценивалась как лечащим врачом, так и самими пациентами согласно следующей шкале: 5 — очень хорошая, 4 — хорошая, 3 — удовлетворительная, 2 — плохая, 1 — очень плохая.
Полученные результаты были статистически обработаны методами вариационной статистики с использованием критериев Стьюдента и представлены в виде таблиц.
Результаты и обсуждение
В основную группу вошли 20 пациентов (7 мужчин и 13 женщин) в возрасте от 18 до 65 лет с клинической картиной рецидивирующего генитального герпеса (табл. 2). Клиническое течение генитальной ГВИ у пациентов основной группы характеризовалось высокой частотой обострений (до 1 раза в 1—1,5 мес), выраженными местными симптомами обострения (зуд, жжение, боль в области поражения). Группу сравнения составили 20 пациентов с аналогичной формой ГВИ, сопоставимые по полу, возрасту и характеру течения заболевания. Более 50% пациентов, вошедших в исследование, в течение последних 3—6 мес применяли только местную терапию (мазь с ацикловиром, интерфероном, растворы антисептиков) герпетических поражений в период рецидива.

Все пациенты, участвующие в исследовании, предъявляли жалобы на появление локальной гиперемии, отека, пузырьковых или эрозивных высыпаний, сопровождавшихся зудом, жжением, болезненностью. До лечения все больные были обследованы для идентификации типа ВПГ (1-й или 2-й) методом полимеразной цепной реакции. Положительный результат получен в 100% случаев. Приблизительно 1/3 пациентов (27,5—37,5%) имели симптомы общей интоксикации в период обострения (головная боль, повышение температуры тела до субфебрильных цифр, слабость). У 45—50% больных присутствовал болевой синдром по ходу пораженных нервов (табл. 3).

На фоне лечения пациентов с генитальной формой ХРГВИ Валвиром длительность рецидива и период полной эпителизации сократились в среднем с 6,4 до 3,8 сут, что достоверно отличается от аналогичных показателей у пациентов, которым был назначен ацикловир (р 
Хорошо известно, что обострение ХРГВИ вызывает появление физической боли, дискомфорта в области поражения и, как следствие, психологическое напряжение больного. Значительное сокращение периода эпителизации (полное заживление) с 6,4 до 3,8 сут на фоне приема валацикловира (Валвира) в дозе 500 мг 2 раза в сутки позволило уменьшить выраженность местных симптомов рецидива и улучшить психологический фон у пациентов в период обострения простого герпеса. При лечении ацикловиром эти показатели изменяются менее значимо с 6,7 до 4,6 дня, что составляет достоверно больший период физического и психологического дискомфорта у обследованных лиц при рецидиве инфекции. Положительным моментом является существенное сокращение продолжительности местных симптомов (зуд, боль, жжение) до 2,5 сут при приеме валацикловира (Валвира) (p
