частичный регресс что это такое
Частичный регресс что это такое
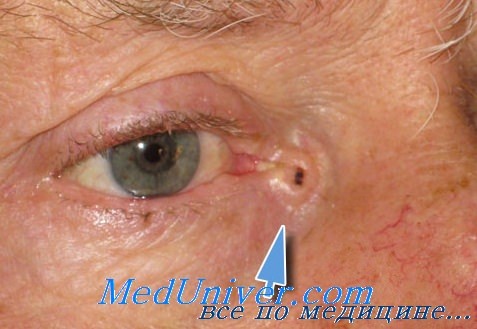
Небольшие раковые образования века и их окружения, остающиеся в покое, не только очень медленно растут и развиваются, но могут иногда совершенно самопроизвольно, без какого-либо специального лечения, потерять свою потенциальную склонность К дальнейшему развитию и, напротив, приобрести склонность к регрессии.
В таких случаях опухоль, первоначально остановившись на некоторое время в своем развитии, неожиданно начинает регрессировать и подвергается постепенному и неуклонному обратному развитию, пока полностью не рассасывается также незаметно, как она в свое время возникла и начала расти.
После этого на веке или на коже в его окружении, где локализовалась такая опухоль, не остается никаких следов бывшего здесь небольшого новообразования.
Сказанное подтверждается имеющимися в литературе сведениями о таком самопроизвольном обратном развитии небольших, но несомненно раковых опухолей. Согласно сообщению Лиша (Lisch), Закс (Sachs), и другие авторы сумели убедиться в том, что в здоровом организме возможно обратное развитие возникшей опухоли и притом не только в самых ранних стадиях ее роста.
Лишу удалось наблюдать случаи, когда рецидивы, возникшие было на веках вследствие недостаточной эксцизии опухоли, приостанавливали свой дальнейший рост и подвергались самопроизвольному обратному развитию, при этом погибали раковые клетки в неудаленных частях опухоли или во вновь возникших рецидивах.
Механизм регрессии развившегося уже было комплекса раковых клеток, успевшего даже и внешне проявить себя в виде небольшого новообразования — раковой опухоли, может быть уяснен только с позиции учения И. П. Павлова о роли и значении коры больших полушарий головного мозга в качестве регуляторного центра, обладающего способностью осуществлять посредством нервных механизмов защитные и компенсаторные функции в любом месте организма.
Процесс самоизлечения происходит либо путем некроза, изъязвления и последующего рубцевания развившейся уже опухоли кожи, либо путем инкапсулирования потерявших потенцию к дальнейшему росту раковых клеток опухолевого зачатка и последующей гибели их в таком инкапсулированном состоянии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Десятилетняя полная регрессия при диссеминированном мелкоклеточном раке легкого с поражением центральной нервной системы после комбинированного лечения
Показана высокая эффективность комбинации иринотекана и цисплатина у пациента с диссеминированным мелкоклеточным раком легкого с поражением центральной нервной системы.
Показана высокая эффективность комбинации иринотекана и цисплатина у пациента с диссеминированным мелкоклеточным раком легкого с поражением центральной нервной системы.
Мелкоклеточный рак легкого (МРЛ) относится к наиболее агрессивным формам рака легкого, в структуре которых на его долю приходится 15–20% [1–4]. Для МРЛ характерны быстрое развитие, раннее и обширное метастазирование. В подавляющем большинстве случаев МРЛ развивается у курящих пациентов, чаще у мужчин. Максимальные показатели заболеваемости отмечаются в возрастной группе 40–60 лет [1–3].
Обычно опухоль начинает развиваться как центральный рак легкого, однако очень скоро метастазирует в бронхопульмональные и медиастинальные лимфоузлы, а также отдаленные органы (кости скелета, печень, головной мозг). Без специального противоопухолевого лечения медиана выживаемости не превышает трех месяцев.
Медиана продолжительности жизни на фоне химиотерапии диссеминированного процесса составляет девять месяцев. Пятилетняя выживаемость достигает 5–10% [1–3, 5].
Химиотерапию используют как в качестве самостоятельного метода, так и в сочетании с лучевой терапией. Цель лечения – добиться полной ремиссии, которая должна быть подтверждена бронхоскопическими методами. Эффективность лечения оценивают через 6–12 недель после его начала. По этим результатам можно прогнозировать вероятность излечения и продолжительность жизни больного. Самый благоприятный прогноз у тех, кому за указанный период времени удалось достичь полной ремиссии. В эту группу входят больные, продолжительность жизни которых превышает три года.
У пациентов с распространенным МРЛ, у которых основным методом лечения является комбинированная химиотерапия, а облучение проводится только по специальным показаниям, общая эффективность химиотерапии составляет 70%, но полная регрессия достигается лишь в 20% случаев [6, 7].
Больной А.Д. Кузмин, 46 лет (ID: 06/10705).
Диагноз. Центральный мелкоклеточный рак правого легкого, метастазы в лимфатические узлы корня, средостения, шейно-надключичные с обеих сторон, головной мозг. Двусторонний плеврит. Ателектаз верхней доли правого легкого. T4N2M1, стадия IV. Состояние после полихимиотерапии (ПХТ), профилактической лучевой терапии. Полная регрессия всех опухолевых проявлений. Ремиссия заболевания в течение десяти лет.
Гистология. 11624 от 12 мая 2006 г.: мелкоклеточный рак.
Сопутствующие заболевания: хронический простатит. Ремиссия.
Анамнез. С февраля 2006 г. увеличение надключичных лимфатических узлов справа. В апреле 2006 г. госпитализирован в ГКБ № 7 по поводу обострения хронического простатита. При обследовании выявлена опухоль правого легкого. Обратился в РОНЦ им. Н.Н. Блохина. Гистология: 11624 от 12 мая 2006 г.: мелкоклеточный рак (бронхоскопия).
Компьютерная томография (КТ) органов грудной клетки, брюшной полости, головного мозга с внутривенным контрастированием от 19 мая 2006 г. В правой плевральной полости значительное количество жидкости. Верхняя доля правого легкого в ателектазе, верхний долевой бронх не дифференцируется. Верхнее средостение и правая корневая зона заняты массивным опухолевым конгломератом 9,5 × 6,0 см, который распространяется паратрахеально справа, сдавливая и оттесняя трахею влево, достигает верхушки правого легкого. Конгломерат распространяется на оба овальных окна. Отдельные узлы определяются по дуге аорты и в области бифуркации, в переднем средостении слева 2,0 × 2,5 × 3,0 см. Просветы главного и среднего долевого бронхов деформированы. Небольшой выпот в левой плевральной полости. Брюшная полость, печень, почки, надпочечники – без особенностей. Забрюшинные лимфоузлы не увеличены.
Головной мозг – в височных областях с обеих сторон очаги 0,5 и 0,6 см, без отека, не исключены более мелкие очаги в теменных областях.
Ультразвуковое исследование (УЗИ) регионарных лимфатических узлов от 31 мая 2006 г. В шейно-надключичной области справа лимфатические узлы от 0,5 до 2,6 см, 3,6 × 3,9 см, в шейно-надключичной слева – от 1,2 до 1,8 см. В других областях – без особенностей. Диагноз: центральный мелкоклеточный рак правого легкого, метастазы в лимфатические узлы корня, средостения, шейно-надключичные с обеих сторон, головной мозг. Двусторонний плеврит. Ателектаз верхней доли правого легкого.
Лечение. С 25 мая по 25 октября 2006 г. проведено шесть курсов химиотерапии по схеме: иринотекан 65 мг/м 2 (120 мг) в первый и восьмой дни + цисплатин 80 мг/м 2 (150 мг) в первый день каждые три недели.
Первый курс осложнился диареей 4-й степени, в связи с чем доза иринотекана была снижена на 30%.
После второго и четвертого курса отмечалась частичная регрессия, после шестого курса – полная регрессия.
При контрольном обследовании через три месяца сохранялась полная регрессия опухолевого процесса.
КТ органов грудной клетки, брюшной полости, головного мозга с внутривенным контрастированием от 29 ноября 2006 г. На месте опухоли справа от трахеи сохранялось уплотнение клетчатки. Признаков наличия увеличенных лимфоузлов не выявлено. В легких – без очаговых и инфильтративных изменений. Проходимость бронхов не нарушена. Структура вещества мозга не изменена. Желудочки обычных размеров и формы. Смещения срединных структур не зафиксировано. Органической патологии в веществе и желудочках мозга не выявлено.
С 26 февраля по 19 марта 2007 г. проведен консолидирующий курс лучевой терапии на шейно-над-подключичную область с двух сторон с разовой очаговой дозой (РОД) 3 Гр, суммарной очаговой дозой (СОД) 30 Гр, на область правого легкого, средостения – РОД 2,5 Гр, СОД 32 Гр, на весь объем головного мозга – РОД 2,5 Гр, СОД 36 Гр.
УЗИ от 29 ноября 2006 г. Брюшная полость, печень, почки, надпочечники, селезенка – без особенностей. Забрюшинные лимфатические узлы не увеличены. В периферических зонах увеличенные лимфатические узлы не визуализировались.
Бронхоскопия от 30 июля 2007 г. Обе половины гортани подвижны, просвет трахеи широкий, кольца хорошо дифференцированы. Карина прямая, ее основание не расширено. При осмотре обеих половин бронхиального дерева опухолевой патологии не выявлено. Просвет доступных осмотру бронхов не изменен. Слизистая оболочка гладкая, блестящая, розового цвета.
УЗИ от 14 апреля 2016 г. Брюшная полость, печень, почки, надпочечники, селезенка – без особенностей. Забрюшинные лимфатические узлы не увеличены. В периферических зонах увеличенные лимфатические узлы не визуализировались.
Результаты КТ и УЗИ до и после лечения представлены на рис. 1–4.
Несмотря на редукцию доз цитостатиков при проведении двух – шести курсов химиотерапии в связи с возникшей диареей 4-й степени после первого курса, комбинация иринотекана и цисплатина показала высокую эффективность при диссеминированном мелкоклеточном раке легкого с поражением центральной нервной системы. Консолидирующая лучевая терапия на первичную опухоль, зоны локального метастазирования, головной мозг позволила длительно закрепить достигнутый эффект от лечения.
Частичный регресс что это такое
В.Ф. Семиглазов, В.В. Семиглазов, А.Е. Клецель, Е.К. Жильцова,
В.Г. Иванов, А.А. Божок, Р.В. Донских, С.Г. Петровский, Р.М. Палтуев,
Г.А. Дашян, К.Ю. Зернов, А.В. Ефименко, И.А. Кочетова
НИИ онкологии им. проф. Н.Н. Петрова, Санкт-Петербург, Россия
Хотя неоадъювантное системное лечение РМЖ имеет уже 15-летнюю историю, оно пока не вошло в стандарт лечения этих опухолей. Достаточно сказать, что в мире имеется лишь 6 опубликованных рандомизированных испытаний неоадъювантной химиотерапии и четыре рандомизированных испытания неоадъювантной гормонотерапии (два с участием НИИ онкологии им.проф. Н.Н.Петрова). Многие врачи, опираясь на «персональный опыт» полагают, что неоадъювантная химиотерапия эффективнее и безопаснее гормонотерапии, т.к. позволяет в относительно короткие сроки (9-12 недель) добиться заметного регресса опухоли для выполнения хирургического этапа (от мастэктомии до органосохраняющей операции в зависимости от остаточного размера опухоли).
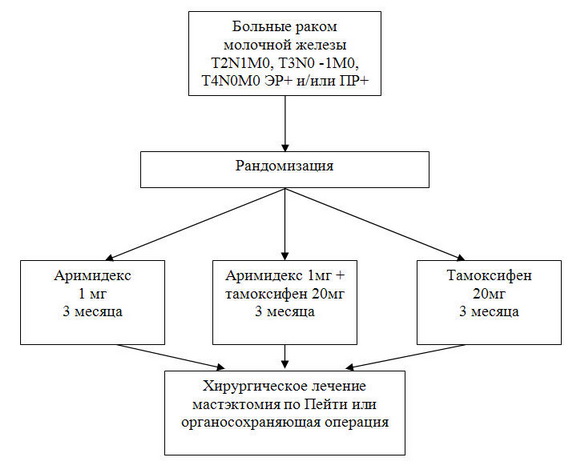
В НИИ онкологии с 1997 по 2004г. было проведено четыре рандомизированных испытаний неоадъювантной эндокринотерапии РМЖ. Первое из них выполнено в рамках Международного многоцентрового протокола 024 «Неоадъювантная гормонотерапия летрозолом против тамоксифена у женщин с РМЖ ЭР+/ПР+ в постменопаузе» (спонсор компания «Новартис» (Швейцария)).
Дизайн исследования и схема рандомизации представлены на рис.1.
Рис. 1. Дизайн клинических испытаний неоадъювантной эндокринотерапии в НИИ онкологии им.проф. Н.Н.Петрова.
Основной целью исследования было сравнение величины объективных ответов опухоли на лечение (частичный или полный регресс опухоли) определяемый с помощью клинического метода (пальпация), рентгеномаммографии и ультразвукового исследования (до начала и после окончания неоадъювантной эндокринотерапии). Одной из целей исследования было также определение частоты выполнения органосохраняющих операций в различных лечебных группах.
Для оценки величины ответа опухоли на лечение в работе использованы стандартные критерии ВОЗ с двухмерным измерением наибольших диаметров.
При клинической оценке (пальпация) полный ответ опухоли наблюдался у 13,3% больных 1-й группы (получавших лечение аримидексом), 10,3% больных 3-й группы (получавших тамоксифен) и ни разу во 2-й группе (получавших комбинированное лечение аримидексом и тамоксифеном (табл.1). Частичный ответ достоверно чаще наблюдался в группе больных, получавших один аримидекс по сравнению с леченными тамоксифеном или получавшими комбинированное лечение (тамоксифен + аримидекс) (80% против 48% против 42%, Р=0,048). При оценке лечебного эффекта с помощью маммографии объективный ответ (частичный или полный регресс опухоли) наблюдался у 55,5% больных, получавших аримидекс, 40% больных, получавших комбинированное лечение (А+Т) и 36% больных, получавших тамоксифен (Р=0,058). При изучении лечебного эффекта с помощью динамического ультразвукового исследования молочных желез объективный ответ зарегистрирован у 44% больных, получавших аримидекс, 32% больных, получавших комбинированную эндокринотерапию (А+Т) и 30% больных, получавших один тамоксифен.
Органосохраняющие операции (сегментарная резекция + подмышечная диссекция) были выполнены у 42% больных 1-й группы (получавших один аримидекс), у 30% больных, получавших комбинированную эндокринотерапию (А+Т) и 30% больных, получавших один тамоксифен, р=0,056.
Любой вариант эндокринотерапии легко переносился пациентами. Наиболее частым побочным эффектом лечения оказались приливы, встретившиеся соответственно по группам в 21%, 24%, 25% случаев (р>0,5). При наблюдении за больными в течение 38 месяцев не отмечалось смертельных исходов из-за осложнений лечения.
Вторичной целью исследования было определение частоты выполнения органосохраняющих операций в различных лечебных группах.
Как видно из таблицы 3 предоперационная (неоадъювантная) терапия экземестаном (аромазином) оказалась значительно более эффективной, чем лечение тамоксифеном. При клинической оценке величина общего объективного ответа опухоли на терапию аромазином оказалась почти в два раза выше, чем на лечение тамоксифеном (90.5% против 48.4%, Р=0.049). При рентгеномаммографической оценке абсолютные показатели ниже, чем при клинической оценке, но тенденция превосходства аромазина над тамоксифеном сохраняется, особенно по частоте частичного ответа опухоли (58% против 20%).
Число больных с прогрессированием заболевания во время эндокринотерапии оказалось выше в группе «тамоксифен» (10% против 3.4%, P=0.076) [табл. 4]. Важным критерием эффективности неоадъювантного лечения оказалась частота выполнения органосохраняющих операций у больных, которым до неоадъювантной эндокринотерапии планировалась радикальная мастэктомия. После завершения предоперационного лечения органосохраняющие операции (сегментарная резекция, квадрантэктомия + подмышечная диссекция) выполнены у 31,6% больных, получавших лечение экземестаном, и у 13.3% больных, леченных тамоксифеном (Р=0.048).
Таблица 3. Клиническая оценка величины ответа опухоли на неоадъювантную эндокринотерапию экземестаном (аромазином) против тамоксифена у постменопаузальных больных РМЖ с ЭР+/ПР+ опухолями (НИИ онкологии им. проф. Н.Н.Петрова, 1997-2004)
Как в фильмах не будет: что должен знать о химиотерапии каждый пациент
Химиотерапия — страшно и невыносимо. Об этом говорит нам медиапространство, и неудивительно, что из-за такой гиперболизации многие пациенты боятся ее едва ли не больше, чем самого заболевания. Однако ни один фильм и ни один роман не рассказывает, что это такое, как работает и насколько оправдан страх лекарственного лечения. Вместе с химиотерапевтом клиники «Луч» и научным сотрудником СПбКнПЦСВМП(о) Марией Степановой мы составили инструкцию для пациентов и разобрались, что такое лекарственная терапия и от чего зависит схема лечения.
Что такое лекарственное лечение
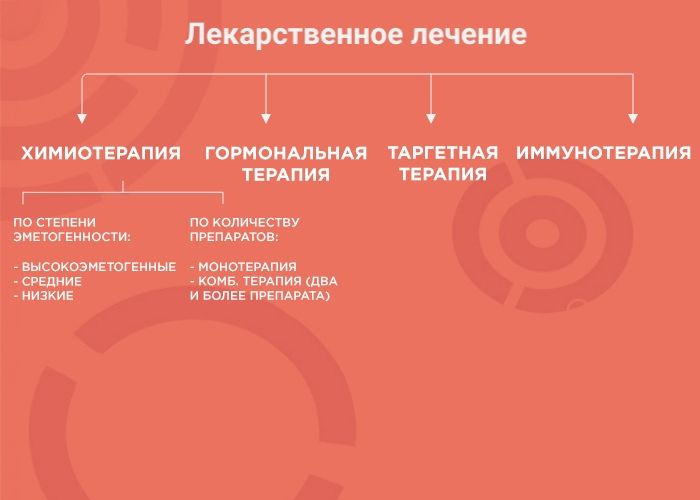
Лекарственная терапия — один из вариантов лечения онкологических заболеваний. Ее возможности и эффективность зависят от типа злокачественного образования. В лекарственной терапии выделяется четыре вида: химиотерапия, наиболее изученный вид терапии; гормонотерапия; таргетная терапия (англ. target «цель, мишень») и иммунотерапия, самый молодой и мало изученный вид лечения. Чтобы понять, почему врач выбирает тот или иной вид терапии, давайте рассмотрим каждый из них более подробно.
Химиотерапия (ХТ)
Некоторые до сих пор ошибочно считают, что лекарственная терапия сводится исключительно к химиотерапии. Действительно, долгое время лекарственное лечение злокачественных опухолей отводилось цитостатикам, противоопухолевым препаратам, принцип действия которых — разрушение быстро делящихся клеток. В том числе — злокачественных.
— Для пациента, который беспокоится о выраженности тошноты важно знать, какие препараты входят в конкретно его схему лечения. Я всегда рассказываю об этом и при необходимости назначаю препараты для снижения побочных эффектов. Чаще всего это сочетание внутривенного и таблетированного вариантов противорвотных препаратов. Однако, плохое самочувствие может нагнать пациента уже дома, и тогда я обсуждаю это и назначаю препараты, которые он может принимать без надзора врача.
— Получается, как в фильмах бывает редко?
— Крайне редко! Конечно, мутить будет, и многие сравнивают это ощущение с токсикозом во время беременности. В таких случаях я рекомендую пить чай с имбирем, использовать жевательные резинки, карамель с кислым вкусом, соленые и кислые продукты.
При химиотерапии используют множество препаратов с разным механизмом действия, ориентированным под разные особенности опухоли. Поэтому врачи используют либо монотерапию (один препарат), либо комбинированное лечение (два и более препарата). Это позволяет усилить противоопухолевый эффект и уменьшить вероятность развития устойчивости опухоли к лечению.
Выделяют также чувствительные к ХТ опухоли (например, герминогенные опухоли, хорионкарциномы, лимфомы) и опухоли, малочувствительные к ХТ (меланома, некоторые виды сарком). Чтобы найти оптимальные варианты лечения для увеличения продолжительности жизни, сейчас активно ведутся клинические исследования о возможности комбинировать этот вид терапии с иммунотерапией.
Гормональная терапия (ГТ)
При гормональной терапии применяются препараты, подавляющие выработку в организме его естественных гормонов или их взаимодействие с рецепторами. Самый частый вариант опухоли, где применяется данный вариант лечения, — рак молочной железы (РМЖ). При выполнении иммуногистохимического (ИГХ) исследования и наличии положительных рецепторов эстрогена и/или прогестерона, оптимальной опцией лечения является гормонотерапия. С ее помощью, можно остановить опухолевый рост и даже добиться полного или частичного исчезновения опухоли.
— Особенность применения этих препаратов, в том что они в подавляющем случае в таблетированной форме и имеют приемлемую токсичность по сравнению с ХТ. Это позволяет пациентам совмещать лечение с работой, хобби и путешествиями.
Таргетная терапия (ТТ)
В отличие от ХТ таргетные (целенаправленные) препараты атакуют только опухолевые клетки. Опухоль для ТТ — своего рода мишень, уничтожение которой означает прекращение репликации (воспроизведения) клеток и метастазирования.
Все началось с того, что врачи отметили недостаточный эффект от цитостатиков и начали внедрять иммуногистохимические параметры. Иммуногистохимическое исследование (ИГХ) выявляет в образце ткани белки, специфичные для того или иного вида клеток. Это позволяет отличать один вид опухоли от другого и выявлять маркеры, которые отвечают за лекарственную чувствительность опухолевой ткани.
— Таргетная терапия начинается с немелкоклеточного рака легкого: в порыве клинических исследований врачи разработали препарат, который начали применять в рамках клинических исследований. Широкое использование Ирессы в клинической практике сопровождалось преимущественно разочарованиями, связанными с редкостью проявления лечебного эффекта. Загадка разрешилась достаточно быстро: анализ нуклеотидной последовательности гена EGFR, проведенный тремя независимыми исследовательскими коллективами, установил, что опухоли легких, характеризующиеся чувствительностью к Ирессе или Тарцеве, содержат мутированную форму этого рецептора. Таким образом, с 2009 года Ирессу внедрили в клиническую практику для пациентов имеющих мутацию в гене EGFR. Особенность механизма действия ТТ, заключается в блокировании мутации, в результате чего опухоль не может делиться, — поясняет Мария.
Побочные эффекты при таргетной терапии менее выражены, и пациенту чаще всего не нужно находиться в стационаре. Некоторые таргетные препараты используются в таблетированной форме, во время их приема качество жизни пациента значительно не страдает, и пациенты могут вести привычный образ жизни.
Иммунотерапия (ИТ)
Иммунотерапия — самая молодая отрасль лекарственного лечения. Существует несколько групп иммунопрепаратов с разными механизмами действия. Одни воздействуют на звено образования кровеносных сосудов в опухоли и блокируют их развитие (после чего опухоль перестает получать питание и погибает), а другие активируют и направляют иммунные силы организма на борьбу с опухолью. занимает много времени, имеет свой спектр побочных эффектов, а также требует внимания врачей и тщательной оценки динамики состояния пациента.
— По идее мы с помощью введения препаратов обучаем иммунную систему распознавать клетки опухоли и разрушать их. Это все равно что установить антивирус, — объясняет Мария.
Цели и оценка эффективности лекарственного лечения
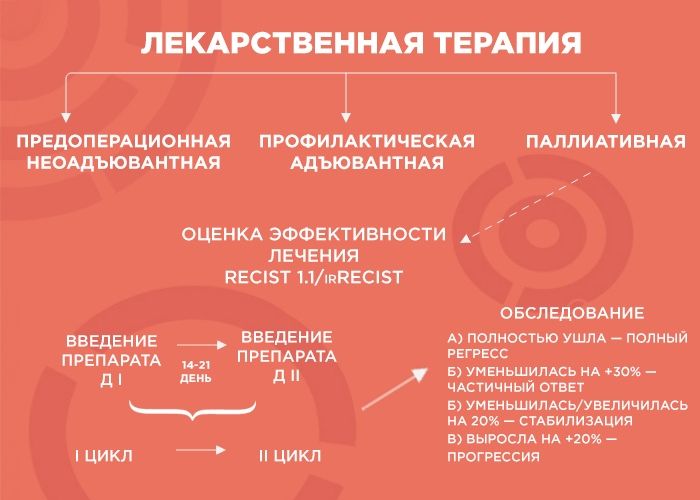
Лекарственная терапия бывает трех видов: предоперационная (неоадъювантная), профилактическая (адъювантная) и паллиативная (поддерживающая).
— Как проходит лечение в каждом из случаев?
— Начнем с предоперационной лекарственной терапии. Например, в отделение поступает пациент с диагнозом рак желудка. Результаты КТ показывают, что отдаленных метастатических очагов нет, однако в связи с распространением первичной опухоли операция на первом этапе невозможна. В этом случае лечение выглядит так: четыре курса терапии, затем — операция, а после нее — еще четыре курса адъювантной терапии. Зачем еще? Формально опухоль убрали, но есть риск возврата образования, и адъювантная терапия помогает его отсрочить.
Паллиативную терапию врач выбирает, когда хирургические методы бессильны (например, при отдаленных метастазах в легкие, печень, лимфоузлы и т.д.). Тогда лечение, в первую очередь, направлено на поддержание качества жизни пациента и контроль заболевания, и продолжительность лечения зависит от его эффекта. В химиотерапии врачи пользуются REСIST 1.1 — системой критериев оценки ответа опухоли на терапию, а в иммунотерапии — irRECIST.
— Объясню, как это работает, на примере пациента с опухолью толстой кишки и с множественными метастазами в печени и легких. Чтобы оценить серьезность ситуации, мы проводим обследование, выявляем наиболее измеряемые очаги и проводим два-три цикла химиотерапии. Большая часть курсов ХТ — введение препарата. Между первым введением и вторым — 14-21 дней — и этот временной промежуток называется циклом.
Далее мы смотрим и сравниваем. Если опухоль уменьшилась более чем на 30% — это частичный ответ, и нужно продолжать терапию до шести курсов. Если она ушла — это полный регресс, и тоже добавляем четыре курса, чтобы закрепить результат. Если опухоль увеличилась или уменьшилась на 20% — это стабилизация, мы делаем еще два курса и снова смотрим: если ситуация не изменилась, пациент отправляется на химиотерапевтические каникулы до прогрессирования заболевания, а потом схема повторяется.
Но если опухоль на фоне лечения выросла больше чем на 20% — мы имеем дело с прогрессией, вероятнее всего, это говорит нам об агрессивности опухоли. В этом случае я объясняю пациенту, что с ним происходит и почему мы меняем лечение.
— Как уговорить пациента на лечение?
— К каждому нужен индивидуальный подход. Я всегда говорю: «Химия может ухудшить ваше состояние, но бояться этого не стоит — мы попытаемся подобрать оптимальную симптоматическую терапию, которое уменьшит нежелательные явления». Если после этого во время лечения появятся данные о плохой переносимости, мы подумаем об уменьшении дозы цитостатика. Бывают случаи, когда я буквально уговариваю пациента пойти на терапию и объясняю ему, за что мы боремся. И объясняю это вне зависимости от серьезности случая — если при агрессивной опухоли человек настроен бороться до последнего, моя обязанность ему эту возможность дать.
Гистологическая оценка ответа опухоли на химио-/лучевую терапию
Резюме. Оценка ответа опухоли на лечение (ОО) является важным критерием эффективности химио-/лучевой терапии и прогноза онкологического заболевания. Лучевые и клинические методы, предоставляя ценную информацию, все же не дают полной характеристики ОО и должны быть дополнены гистологическим исследованием, которое, кроме детальной оценки эффективности терапии, значительно повышает достоверность прогноза. Основным гистологическим параметром при оценке ОО на сегодня является объем сохранивших жизнеспособность опухолевых элементов. Однако понимание того, что для характеристики ОО важна не только оценка объема резидуальных опухолевых элементов, но и других признаков, заставляет исследователей искать пути для создания систем многофакторного анализа ОО, пригодных для широкого повседневного использования в медицинской практике.
Ответ опухоли на лечение (ОО) представляет собой комплекс индуцированных противоопухолевой терапией альтеративно-деструктивных изменений в новообразовании. Его оценка имеет особое значение для определения эффективности неоадъювантной терапии, завоевавшей принципиально важное место при лечении злокачественных новообразований [38, 49]. Она улучшает выживаемость больных с резектабельными и помогает конвертировать часть пациентов с исходно неоперабельными опухолями до резектабельного статуса [22, 56]. Предоперационная лучевая/химиотерапия может изменить Т и N статус заболевания. Это достигается за счет уменьшения, в той или иной степени, размеров и инвазии опухоли вплоть до полной элиминации ее элементов, в том числе и в лимфатических узлах. Такая регрессия опухоли со снижением по сравнению с предоперационной T/N-категории используется для оценки ОО [41, 50, 51, 70]. Уменьшение размеров опухоли стали рассматривать в качестве признака ее радио- или химиочувствительности, а также как важный прогностический фактор [24, 31, 35, 54, 63], коррелирующий с выживаемостью онкологических больных [62, 72].
Для оценки ОО используют прежде всего лучевые методы, с помощью которых регистрируют уменьшение размеров опухоли, а также могут применять методы выявления в крови онкомаркеров [1, 3] и ряда других показателей (лактатдегидрогеназы [6, 60], кальция [7, 46], фосфора [18]).
В 1981 г. ВОЗ была принята клиническая классификация степеней ОО, основанная на изменении линейных размеров новообразования, определяемых лучевыми методами исследования [57]. В 2000 г. она была пересмотрена и представлена как критерии оценки ответа солидных опухолей (Response Evaluation Criteria In Solid Tumors — RECIST), в которой стали использовать двухмерные измерения вместо трехмерных, уменьшено количество измеряемых очагов, сняты критерии прогрессии [71]. В соответствии с этой классификацией различают:
Дальнейшая эволюция RECIST привела к созданию в 2008 г. ее новой версии 1.1 [37], которая отличается как граничными значениями количественных показателей, так и увеличением количества оцениваемых параметров, ранжировки их значимости. Так, RECIST 1.1 включает оценку основных (target lesions) и дополнительных (non-target lesions) очагов опухолевого поражения (роста).
Оценка основных очагов (количественная) осуществляется по критериям:
Оценка дополнительных очагов (качественная):
Однако лучевые и другие методы оценки ОО ограничены в своей способности обеспечить точную информацию о Т и N категориях, и при ответе, расцененном как полный лучевыми методами, часто гистологически в операционном материале выявляются элементы опухоли [29, 45, 52, 65, 71].
При попытке показать наличие резидуальных опухолевых элементов при помощи биопсии, которая сравнительно легко осуществима и имеет мало осложнений, обнаружили их низкую достоверность [23, 52, 61]. Рядом исследователей продемонстрировано, что в 35–50% случаев, когда при ребиопсиях не выявляли опухолевых элементов, их обнаруживали в резецированном материале [27, 33, 64, 67].
Таким образом, лучевые и клинические методы, предоставляя ценную информацию, все же не подходят для определения полной ликвидации первичной опухоли, предполагающей полное отсутствие опухолевых клеток после неоадъювантной химио-/лучевой терапии. Кроме того, достоверность прогноза как при полной, так и неполной регресссии опухоли существенно повышается при гистологической оценке ОО. Следовательно, достоверная оценка ОО должна включать гистологическое исследование операционного материала.
Гистологическая оценка ОО на территории постсоветских государств чаще всего именуется лечебным патоморфозом [2, 4, 19].
С целью повышения информативности оценки ОО был разработан ряд гистологических систем, базирующихся на количественных или качественных критериях, а также их сочетании. В основу всех систем гистологической оценки ОО легло определение степени клеточности опухоли и распространенности в ней некротических изменений. К сожалению, некроз опухоли с трудом поддается количественному определению, и большинство исследователей не оценивает этот показатель. Несмотря на методологические различия предложенных классификаций, все авторы подчеркивают, что полный ОО означает полное отсутствие опухолевых клеток в исследуемом материале. Основное внимание в существующих шкалах оценки ОО, прежде всего, уделяется определению относительной части опухоли, сохранившей жизнеспособность, и/или степени ее повреждения. Прогноз же заболевания зависит не только от объема сохранившей жизнеспособность опухолевой ткани, но и от ее потенциальных биологических свойств.
При оценке ОО необходимо также учитывать, что в опухолях, не подвергшихся химио-/лучевой терапии, с минимальным поперечником 3 см и более дистрофические и некротические изменения могут охватывать 30% и более их объема. Это требует критического отношения к ОО в этих пределах и экстраполяции данных на подобные опухоли, не подвергшиеся антибластемному лечению.
Все гистологические классификации ОО требуют, чтобы оценка резидуальных опухолевых элементов осуществлялась на максимально информативном материале [4, 5, 27, 29, 33, 45, 52, 65, 67, 71]. Так, для первичной опухоли наиболее информативным является исследование образцов резекции. При этом максимального внимания и тщательного исследования заслуживают те случаи, в которых после лечения клиническими и лучевыми методами, а также при визуальной оценке резецированного материала опухоль не обнаруживается.
Одной из первых гистологических классификацией выраженности ОО (лечебного патоморфоза) была схема, предложенная Е.Ф. Лушниковым [11, 12, 13], согласно которой выделяют 4 степени лечебного патоморфоза, характеризующиеся следующими признаками:
Одной из наиболее распространенных методик оценки лечебного патоморфоза на постсоветском пространстве стала схема Г.А. Лавниковой [8, 9, 10]. Она основана на учете изменения общей структуры опухоли на тканевом (соотношение строма/паренхима, структурная атипия) и клеточном уровне (степень дистрофии и полиморфизма клеток, митотическая активность). Данная классификация выделяет 4 степени ОО:
Для объективизации оценки лечебного патоморфоза по Г.А. Лавниковой используется количественный показатель — индекс повреждения (ИП), рассчитываемый по формуле:
Пк — средний объем жизнеспособной опухолевой паренхимы (без лечения);
Пл — средний объем жизнеспособной опухолевой паренхимы (после лечения);
ИП — индекс повреждения в процентах (от 100 до 0).
Для определения индуцированных лечением некрозов в опухолевой ткани используется формула:
В — количество клеток в некрозе;
С — общее количество опухолевых клеток;
А — процент клеток в состоянии некроза по отношению ко всем опухолевым клеткам.
Для злокачественных опухолей костей A. Huvos [47, 48] была предложена 4-ступенчатая схема ОО, где:
Для оценки ОО пищевода была предложена схема A.M. Mandard и соавторов [55] (табл. 1), которая в последующем была успешно модифицирована для метастазов в печень [62]. Она включает 5 степеней регрессии опухоли (Tumor Regression Grade — TRG) в зависимости от наличия остаточных опухолевых клеток и степени фиброза. В отличие от классификации ВОЗ, которая делает различие только между полным ответом и регрессией опухоли более чем на 50%, эта система различает степени, при которых ограниченное число опухолевых клеток все еще идентифицируется. При оценке ОО также учитываются качественные изменения опухолевых клеток, такие как вакуолизация и/или эозинофилия цитоплазмы, явления пикноза ядер, некроз, а также степень воспалительной инфильтрации, в том числе наличие гигантских клеток.
Таблица 1 Степени регрессии опухоли в ответ на лечение по A.M. Mandard et al. (1994) [56]
| I степень регрессии опухоли (полная регрессия) (TRGl) — отсутствие опухолевых клеток, наличие очага фиброза на месте опухоли (возможно отсутствие фиброза [63]) |
| II степень регрессии опухоли (TRG2) — сохранение немногочисленных опухолевых клеток на фоне фиброзных изменений |
| III степень регрессии опухоли (TRG3) — большое количество сохраненных опухолевых клеток на фоне преобладания фиброза |
| IV степень регрессии опухоли (TRG4) — опухолевые элементы преобладают над фиброзными изменениями |
| V степень регрессии опухоли (TRG5) — отсутствие признаков регрессии опухоли, отсутствие фиброза |
Rubbia и соавторы [62], оценивая ответ метастазов печени на лечение, учитывали также относительную распространенность некроза: класс 0 соответствует отсутствию некроза, класс 1 — до 25%; класс 2 — 25–50%, класс 3 — 50–75%; класс 4 — более 75% площади опухоли в состоянии некроза. При множественных метастазах общая оценка осуществляется по худшему показателю. В качестве дополнительного показателя данные авторы обращают внимание на преимущественное распределение живых опухолевых клеток: в центре, диффузное по всему объему либо по периферии опухоли.
Классификация ОО по I.D. Miller и соавторам [58] была разработана с учетом показателей общей выживаемости пациентов в зависимости от степени патоморфологической регрессии опухоли, учитывающей при этом состояние лимфатических узлов. В классификации выделено пять степеней ОО, но только при полном отсутствии опухолевых клеток в первичной опухоли и в регионарных лимфатических узлах устанавливается полный ОО:
Для количественной микроскопической оценки эффективности предоперационной (неоадъювантной) терапии больных со злокачественными новообразованиями предложена К.А. Галахиным и соавторами [4] семиступенчатая шкала, основанная на определении относительной доли жизнеспособной опухолевой ткани (ОДЖОТ):
Кельнская система классификации регрессии опухоли (The Cologne Regression Classification System), основанная на принципах классификации ВОЗ и выделяющая 4 класса ОО, изначально предназначалась для оценки карциномы легких [26, 43]. Она базируется на измерении соотношения объема жизнеспособных и некротически измененных элементов опухоли, дополняемых качественными показателями изменений, вызванных терапией. Последние включают в себя главным образом выраженность фиброза, количество гистиоцитов, а в некоторых опухолях — наличие гигантских клеток резорбции. Эти и другие (неспецифические) явления, такие как присутствие лимфоцитов, гранулоцитов и эозинофилов оцениваются полуколичественно (слабая, умеренная и выраженная). Основными характеристиками классов регрессии опухоли являются:
Близкой по сути к Кельнской системе классификации регрессии является схема ОО, предложенная Shimosato и соавторами [66], в которой оценка ОО распространяется на лимфатические узлы:
Японским обществом исследований рака желудка (The Japanese Research Society for Gastric Cancer) разработана аналогичная классификации ВОЗ четырехуровневая система оценки ОО для рака пищевода, но с несколько иными критериями группировки [42, 68]:
При ее использовании применительно к раку желудка [28, 66] и пищевода [42] было показано, что вероятность выживания значительно выше в случае регрессии опухоли более чем на ⅔.
Попытка объединить разные количественные и качественные признаки ОО и, таким образом, повысить объективность оценки лечебного патоморфоза и его прогностической значимости предпринята А.А. Суховерша и соавторами [20, 21]. Этот метод включает в себя определение объемов индуцированных терапией изменений опухоли, изменений объемов жизнеспособной, дистрофической и дискомплексированной ткани в остаточной опухоли, характеристики пролиферативной активности и апоптоза онкоцитов, характер и выраженность воспалительной реакции (табл. 2). Степень ОО по А.А. Суховерша и соавторам определяется по сумме балов: 0 степень — 0 баллов; I степень — 1–9 баллов; II степень — 10–18 баллов; III степень — 19–27 баллов. Такой многофакторный подход в оценке ОО, с точки зрения авторов, повышает объективность и прогностическую значимость метода, объясняет случаи ранней генерализации, местных рецидивов опухоли.
Таблица 2 Схема оценки лечебного патоморфоза опухоли по А.А. Суховерша и соавторам [20]
| Параметры патоморфоза | Градация и объем параметров (баллы) | |||
|---|---|---|---|---|
| 1 | 2 | 3 | ||
| Структура опухоли | Соотношение объемов индуцированных изменений и первичной опухоли, % | 70 | ||
| Объем жизнеспособной ткани в остаточной опухоли, % | > 70 | 30–70 | > 30 | |
| Объем дистрофической ткани в остаточной опухоли (нежизнеспособная), % | 70 | |||
| Объем дискомплексированой ткани в остаточной опухоли (минимальныеизменения), % | 70 | |||
| Качественныеизмененияостаточной опухоли | Количество опухолевых клеток-гигантов | 1 | 2–5 | > 5 |
| Митотическая активность | 2 | |||
| Апоптоз онкоцитов | Единичные | Разрозненные | Многочисленные | |
| Воспалительнаяреакция в опухоли | Характеристика, тип реакции | Альтеративная | Продуктивная | Продутивно-гранулематозная |
| Степень | Очаговая | Диффузная | Диффузно-очаговая | |
Гистологически в ОО можно выделить 2 основных этапа изменений — ранние и поздние [4]. Через 7 дней после начала антибластемного лечения в опухолях, независимо от их гистологической разновидности, можно наблюдать типичные дистрофические и альтеративные изменения паренхиматозных элементов на фоне выраженных сосудистых расстройств (стазы, резкое полнокровие, сладж-феномен, микротромбозы, плазмо- и геморрагии) и воспалительную инфильтрацию. Через 2 нед и более от начала неоадъювантной терапии очаги некроза окружаются волокнистой соединительной тканью, и возникает заместительный склероз, гиалиноз, миксоматоз. Вокруг групп опухолевых клеток образуются лимфоплазмоцитарные инфильтраты, появляются гигантские многоядерные клетки инородных тел и ксантомные клетки, образуются лимфоцитарные периваскулярные муфты. Следует особо отметить градиентный характер альтеративных изменений в опухоли, выраженность которых постепенно убывает от центра к ее периферии.
Описанные явления вполне можно характеризовать как стереотипную динамическую реакцию соединительной ткани на альтерацию опухолевой паренхимы, когда молодая пролиферирующая соединительная ткань замещает очаги некрозов и кровоизлияний (5–10-е сутки), а затем подвергается ремоделированию.
Доминирующей морфологической особенностью при умеренной и слабой степени ОО после неоадъювантной терапии злокачественных эпителиальных опухолей пищеварительной трубки является наличие больших площадей жизнеспособных опухолевых элементов, чередующихся с зонами некроза, с отсутствующими или незначительными участками фиброза. При высокой степени ОО с выраженными явлениями фиброза характерно резкое уменьшение или полное исчезновение опухолевых элементов. Это позволило выдвинуть концепцию [34, 39, 62], что некрозы опухолевой паренхимы, скорее всего, связаны с недостаточным кровоснабжением опухоли, в то время как цитотоксические эффекты химиотерапии реализуются с помощью других механизмов, таких как апоптоз.
Как уже упоминалось выше, в большинстве случаев ОО явления некроза или фиброза преобладают в центре, а жизнеспособные элементы опухоли располагаются преимущественно по ее периферии. Такая картина более заметна после химиотерапии в выростах по краям опухоли, где жизнеспособные опухолевые клетки соседствуют с неопухолевыми тканями [62]. Сохранность жизнеспособных опухолевых клеток на периферии новообразования может быть обусловлена более высоким гидростатическим давлением в этих участках и меньшей эффективностью лекарственной диффузии [44]. С практической стороны, обнаружение жизнеспособных клеток на периферии опухоли должно быть принято во внимание при определении объема резекции и может указывать на пределы одноигольной радиоабляции опухоли [69].
Оценка ОО подразумевает не только определение эффективности терапии, но и прогнозирование течения заболевания для планирования и коррекции последующих этапов лечения, а также определения целесообразности операции [30]. Четко показано, что в таких опухолях, как рак грудной железы [17, 25, 32, 34, 36] гистологический ответ на предоперационную химиотерапию прямо коррелирует с безрецидивной и общей выживаемостью. Высокая степень значимости гистологической оценки ОО как прогностического фактора подтверждена для опухолей двенадцатиперстной кишки, пищевода [55], карцином толстой кишки [31, 63] и ряда других новообразований.
Таким образом, оценка ОО является важным критерием в определении эффективности химио-/лучевой терапии и прогноза онкологического заболевания. Гистологическая оценка ОО на сегодня получила меньшее распространение, чем лучевые методы. Это связано, прежде всего, с трудоемкостью такого исследования и степенью объективности получаемых данных.
Гистологически исследуют лишь часть опухоли, а полученные данные экстраполируют на весь ее объем, предполагая, что изменения, индуцированные терапией, равномерно проявляются во всем ее объеме, что является весьма условным. Также не вполне объективной является оценка соотношения в опухоли жизнеспособной и некротической ткани, поскольку четкие границы между ними отсутствуют. Кроме того, учитывая то, что в опухоли могут наблюдаться спонтанные некрозы, оценка случаев, когда резидуальные опухолевые элементы после химио-/лучевой терапии составляют более 50%, является сомнительной для прогноза заболевания у конкретного пациента. Учет невысоких значений ОО представляет интерес при сравнении групп пациентов с опухолями одинаковой локализации, размеров и гистологического типа у пациентов, не получавших терапию.
Особо следует отметить, что поскольку опухоли различной органной принадлежности и гистологического типа обладают различными свойствами, то объемы резидуальных элементов в разных новообразованиях будут иметь различное прогностическое значение [47, 55, 62].
Основным гистологическим параметром ОО на сегодня является объемная доля сохранивших после лечения жизнеспособность опухолевых элементов. Другие параметры, такие как распространенность некроза, сосудистые изменения, воспалительную инфильтрацию, как правило, рассматривают как дополнительные факторы и оценивают качественно или полуколичественно. Однако понимание того, что для характеристики ОО важна не только оценка объема резидуальных опухолевых элементов, но и других факторов, заставляет исследователей искать пути для создания систем многофакторного анализа ОО.
Исходя из анализа данных литературы, а также опыта работы отдела патологической анатомии Национального института рака, наибольшую ценность гистологическая оценка ОО может иметь при случаях, когда с помощью лучевых методов не отмечают изменения размеров опухоли или это не возможно (внутрикостные опухоли); при резком уменьшении размеров опухоли для выявления остаточных мелких жизнеспособных опухолевых элементов; при сравнительной оценке различных способов терапии.
Если гистологическая оценка ОО проводится не непосредственно при микроскопии препарата наиболее доступными способами (например, с использованием окулярных сеток), то это резко увеличивает время для ее осуществления и приводит к значительному увеличению нагрузки на патолога. Особенно это касается использования систем многофакторной оценки ОО, таких как в методике А.А. Суховерша и соавторов [20, 21].
Учитывая, что при гистологической оценке ОО важным представляется целый ряд признаков, но их учет является крайне трудоемким и длительным, то широкое внедрение высокоэффективных многофакторных способов оценки гистологического ОО возможно лишь на базе автоматизированного анализа.
Исходя из известного факта, что в ряде случаев после достижения хорошего ОО через определенное время возникают рецидивы опухоли и отдаленные метастазы, которые бурно развиваются и проявляют высокую резистентность к терапии, по всей видимости, целесообразно уделять внимание биологическим свойствам резидуальных опухолевых клеток, выявляемых иммуногистохимическими, молекулярными и генетическими маркерами. Вместе с тем при рассмотрении современное состояние вопроса о гистологическом ОО, обращает на себя внимание аспект, что, несмотря на сегодняшнюю «эпоху развитой иммуногистохимии, бурно развивающейся молекулярной биологии и генетики», эти технологии практически не находят места в оценке состояния остаточных элементов опухоли после неоадъювантной терапии. Немногочисленные исследования в этом направлении (например [14, 15, 16, 25, 36, 40, 53, 59, 73]) фрагментарны и неубедительны. Однако в силу гетерогенности неопластических клеток в опухоли часть из них проявляет определенную резистентность к повреждению, а часть подвергается необратимым изменениям. В связи с этим, с нашей точки зрения, свойства резидуальных опухолевых элементов должны представлять интерес для прогнозирования течения онкологического заболевания.
Литература
1. Алексеева М.Л., Гусарова Е.В., Муллабаева С.М., Понкратова Т.С. (2005) Онкомаркеры, их характеристика и некоторые аспекты клинико-диагностического использования (обзор литературы). Проблемы репродукции, 3: 65–78.
2. Василенко И.В., Садчиков В.Д., Галахин К.А. и др. (2001) Предрак и рак желудка. Киев.: Книга-плюс, 229 с.
3. Винтизенко С.И., Слонимская Е.М., Усынин Е.А., Стуканов С.Л. (2009) Использование UBC-теста в качестве уринологического маркера рака мочевого пузыря. Бюллетень сибирской медицины, 2: 113–118.
4. Галахин К.А., Курик Е.Г. (2000) Лечебный патоморфоз злокачественных опухолей пищеварительного тракта. Киев.: Книга-плюс, 176 с.
5. Галахин К.А., Югринов О.Г., Курик Е.Г. и др. (2000) Химиотерапевтический патоморфоз злокачественных опухолей. Укр. хіміотерапевт., 4 (8): 8–11.
6. Журкина О.В. (2007) Лактатдегидрогеназа крови и мочи при доброкачественных и злокачественных новообразованиях почки. Казанский медицинский журнал, 3: 241–243.
7. Кондратьев В.Б. (2000) Метастазы в кости: осложненные формы, гиперкальциемия, синдром компрессии спинного мозга, медикаментозное лечение. Практическая онкология, 2: 41–45.
8. Лавникова Г.А. (1976) Некоторые закономерности лучевого патоморфоза опухолей человека и их практическое использование. Вестн. АМН СССР, 6: 13–19.
9. Лавникова Г.А., Гош Т.Е., Талалаева А.В. (1978) Гистологический метод количественной оценки степени лучевого повреждения опухоли. Мед. радиол., 3: 6–9.
10. Лавникова Г.А. (1979) Гистологический метод количественной оценки терапевтического повреждения опухоли. Москва.: Методические рекомендации, 13 с.
11. Лушников Е.Ф. (1976) Терапевтический патоморфоз опухолей человека в практическом и теоретическом аспектах. Вестник АМН СССР, 6: 7–12.
12. Лушников Е.Ф. (1977) Лучевой патоморфоз опухолей человека. М.: Медицина, 328с.
13. Лушников Е.Ф. (1993) Лечебный патоморфоз опухолей. В книге Патологоанатомическая диагностика опухолей человека. Под ред. Н.А. Краевского, А.В. Смолянникова, Д.С. Саркисова М.: Медицина, 560 с.
14. Мазурик В.К., Мороз Б.Б. (2001) Проблемы радиобиологии и белок р53. Радиационная биология. Радиоэкология. 41(5): 548–572.
15. Максимов С.Я., Гусейнов К.Д., Косников А.Г. и др. (2003) Факторы риска возникновения злокачественных новообразований органов репродуктивной системы женщин. Вопросы онкологии, 49(4): 496–498.
16. Петров С.В., Непомнящая Е.М., Гусарева М.А. (2008) Прогностическое значение некоторых маркеров в меланоме кожи при различных методах лечения. Вопросы онкологии, 6: 744–748.
17. Рошин Е.М., Зубанова А.А., Колядина И.В. и др. (2010) Лечебный патоморфоз как критерий эффективности лечения и прогноза рака молочной железы. Медицинский альманах. РОНЦ РАМН, 3 (12): 48–53.
18. Семенова А.И. (2006) Гиперкальциемия и синдром распада опухоли. Практическая онкология, 7(2): 101–104.
19. Серов В.В. (1997) Учение о патоморфозе: прошлое и настоящее. Арх. патол., 4: 3–5.
20. Суховерша О.А., Біленький І.В., Чекан С.М. (2006) Спосіб оцінки лікувального патоморфозу злоякісної пухлини. Деклараційний патент на корисну модель. № 23830. Опуб. 11.06.2007, бюл. № 8.
21. Суховерша О.А., Біленький І.В., Чекан С.М., Коссе В.А. (2007) Оцінка хіміотерапевтичного патоморфозу недрібноклітинного раку легенів. Морфологія, 1(2): 82–90.
22. Adam R., Delvart V., Pascal G. et al. (2004) Rescue surgery for unresectable colorectal liver metastases down staged by chemotherapy: a model to predict long-term survival. Ann Surg., 240 (4): 644–657.
23. Adelstein D., Rice T., Becker M. et al. (1997) Use of concurrent chemotherapy, accelerated fractionation radiation and surgery for patients with esophageal carcinoma. Cancer, 80: 1011–1020.
24. Ajani J.A., Mansfield P.F., Janjan N. et al. (2004) Multi-institutional trial of preoperative chemoradiotherapy in patients with potentially resectable gastric carcinoma. Journal of Clinical Oncology, 22 (14): 2774–2780.
25. Archer C.D., Parton M., Smith I.E. et al. (2003) Early changes in apoptosis and proliferation following primary chemotherapy for breast cancer Br J Cancer. 15; 89(6): 1035–1041.
26. Baldus S., Monig S., Schroder W. et al. (2004) Regression of oesophageal carcinomas after neoadjuvant radiochemotherapy: criteria of the histopathological evaluation. Pathologe, 25: 421–427.
27. Bates B., Detterbeck F., Bernard S. et al. (1996) Concurrent radiation therapy and chemotherapy followed by esophagectomy for localized esophageal carcinoma. J. Clin. Oncol., 14: 156–163.
28. Becker K., Mueller J., Schulmacher C. et al. (2003) Histomorphology and grading of regression in gastric carcinoma treated with neoadjuvant chemotherapy. Cancer, 98: 1521–1530.
29. Bertheau P., Lerebours F., Mounier N. et al. (2005) Prognostic significance of a combined clinicopathologic score for response to primary systemic therapy in locally advanced breast cancer. Oncol Rep., 14 (2): 513–520.
30. Bollschweiler E., Hölscher A.H, Metzger R. (2010) Histologic tumor type and the rate of complete response after neoadjuvant therapy for esophageal cancer. Future Oncology, 6 (1): 25–35.
31. Bouzourene H., Bosman F.T., Seelentag W. et al. (2002) Importance of tumor regression assessment in predicting the outcome in patients with locally advanced rectal carcinoma who are treated with preoperative radiotherapy. Cancer, 94 (4): 1121–1130.
32. Bramwell V.H. (1997) The role of chemotherapy in the management of non-metastatic operable extremity osteosarcoma. Semin Oncol., 24 (5): 561–571.
33. Brown W., Thomas J., Gotley D. et al. (2004) Use of oesophagogastroscopy to assess the response of oesophageal carcinoma to neoadjuvant therapy. Br. J. Surg., 91: 199–204.
34. Chang J., Ormerod M., Powles T.J. et al. (2000) Apoptosis and proliferation as predictors of chemotherapy response in patients with breast carcinoma. Cancer, 89 (11): 2145–2152.
35. Chollet P., Amat S., Cure H. et al. (2002) Prognostic significance of a complete pathological response after induction chemotherapy in operable breast cancer. Br J Cancer, 86 (7): 1041–1046.
36. Darcy K.M., Birrer M.J. (2010) Translational research in the Gynecologic Oncology Group: evaluation of ovarian cancer markers, profiles, and novel therapies. Gynecol Oncol.; 117(3): 429–39.
37. Eisenhauer E.A., Therasse P., Bogaerts J. et al. (2009) New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1). European journal of cancer, 45: 228–247
38. Fernandez F.G., Drebin J.A., Linehan D.C. et al. (2004) Five-year survival after resection of hepatic metastases from colorectal cancer in patients screened by positron emission tomography with F-18 fluorodeoxyglucose (FDG-PET). Ann Surg., 240 (3): 438–447.
39. Gourdier I., Crabbe L., Andreau K. et al. (2004) Oxaliplatin-induced mitochondrial apoptotic response of colon carcinoma cells does not require nuclear DNA. Oncogene, 23 (45): 7449–7457.
40. Grossman H.B., Tangen C.M., Cordon-Cardo C. et al. (2006) Evalution of Ki67, р53 and angiogenesis in patients enrolled in a randomized study of neoadjuvant chemotherapy with or without cystectomy: a Southwest Oncology Group Stydy. Oncol Rep. Oct; 16(4): 807–810.
41. Janjan N.A., Khoo V.S., Abbruzzese J. et al. (1999) Tumor downstaging and sphincter preservation with preoperative chemoradiation in locally advanced rectal cancer: The M.D. Anderson Cancer Center experience. Int J Radiat Oncol Biol Phys., 44: 1027–1038.
42. Japanese Society for Esophageal Diseases: Guidelines for the Clinical and Pathologic Studies on Carcinoma of the Esophagus (9th Edition). Kanehara and Co. Ltd, Tokyo, Japan (2001).
43. Junker K., Muller K., Bosse U. et al. (2003) Apoptosis and tumor regression in locally advanced non-small cell lung cancer with neoadjuvant therapy. Pathologe, 24: 214–219.
44. Heldin C.H., Rubin K., Pietras K. et al. (2004) High interstitial fluid pressure — an obstacle in cancer therapy. Nat Rev Cancer, 4 (10): 806–813.
45. Husband J.E., Schwartz L.H., Spencer J. et al. (2004) Evaluation of the response to treatment of solid tumours — a consensus statement of the International Cancer Imaging Society. Br J Cancer, 90(12): 2256–2260.
46. Huggia F.M. (1990) Overview of cancer related hypercalcemia: epidemiology and etiology. Semin. Oncol., 17: 3–9.
47. Huvos A.G., Rosen G., Dabska M., Marcove R.C. (1983) Mesenchymal chondrosarcoma a clinicopathologic analysis of 35 patients with emphasis on treatment. Cancer, 51 (7): 1230–1237.
48. Huvos A. G. (1991) Osteogenic sarcoma: pathologic assessment of preoperative (neoadjuvant) chemotherapy. In: Bone tumors: Diagnosis, treatment and prognosis. 2 nd edition, W.B.Saunders, Philadelphia: 122–128.
49. Pawlik T.M., Scoggins C.R., Zorzi D. et al. (2005) Effect of surgical margin status on survival and site of recurrence after hepatic resection for colorectal metastases. Ann Surg., 241 (5): 715–722. discussion 722–724.
50. Picci P., Böhling T., Bacci G., Ferrari S. et al. (1997). Chemotherapy-induced tumor necrosis as a prognostic factor in localized Ewing’s sarcoma of the extremities. J Clin Oncol.,15 (4): 1553–9.
51. Kaminsky-Forrett M.C., Conroy T., Luporsi E. et al. (1998) Prognostic implications of downstaging following preoperative radiation therapy for operable T3–T4 rectal cancer. Int J Radiat Oncol Biol Phys., 42: 935–941.
52. Kwok H., Bissett I.P, Hill G.L. (2007) Preoperative staging of rectal cancer. Int J Colorectal Dis, 15: 9–20.
53. Lazar A.A., Cole B.F., Bonetti M., Gelber R.D. (2010) Evaluation of treatment-effect heterogeneity using biomarkers measured on a continuous scale: subpopulation treatment effect pattern plot. J Clin Oncol. 10; 28(29): 4539–44.
54. Licitra L., Locati L.D., Cavina R. et al. (2003) Primary chemotherapy followed by anterior craniofacial resection and radiotherapy for paranasal cancer. Ann Oncol., 14 (3): 367–372.
55. Mandard A.M., Dalibard F., Mandard J.C. et al. (1994) Pathologic assessment of tumor regression after preoperative chemoradiotherapy of esophageal carcinoma. Clinicopathologic correlations. Cancer, 73 (11): 2680–2686.
56. Mentha G., Majno P., Gervaz P. et al. (2006) Results of inverse strategy using systemic chemotherapy first, liver resection second and primary tumour resection last for patients with advanced synchronous liver metastases from colorectal cancer (SCRLM). Br J Surg., 93: 872–878.
57. Miller A., Hoogstraten B., Staquet M., Winkler A. (1981) Reporting results of cancer treatment. Cancer, 47: 207–214.
58. Miller I.D., Payne S., Ogston K.N. (2002) A new histological grading system to assess response of breast cancer to primary chemotherapy. Int J Oncol., 20 (4): 791–796.
59. Moreno Garcia V., Cejas P., Feliu J. et al. (2009) Immunohistochemical analysis of tumor regression grade for rectal cancer after neoadjuvant chemoradiotherapy. J Clin Oncol, 27 (suppl; abstr e22089).
60. Motzer R..J., Masumdar M., Bacic J. et al. (1999) Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma. J. Clin. Oncol., 17 (8): 2530–2540.
61. Ribeiro A., Franceschi D., Parra J. et al. (2006) Endoscopic ultrasound restaging after neoadjuvant chemotherapy in esophageal cancer. Am. J. Gastroenterol, 101: 1216–1221.
62. Rubbia-Brandt L., Giostra E., Brezault C. et al. (2007) Importance of histological tumor response assessment in predicting the outcome in patients with colorectal liver metastases treated with neo-adjuvant chemotherapy followed by liver surgery. Ann Oncol., 18 (2): 299–304.
63. Rullier A., Laurent C., Vendrely V. et al. (2005) Impact of colloid response on survival after preoperative radiotherapy in locally advanced rectal carcinoma. Am J Surg Pathol., 29 (5): 602–606.
64. Sarkaria I., Rizk N., Bains M. et al. (2009) Post-treatment endoscopic biopsy is a poor-predictor of pathologic response in patients undergoing chemoradiation therapy for esophageal cancer. Ann. Surg., 249: 764–767.
65. Schott A.F., Roubidoux M.A., Helvie M.A. et al. (2005) Clinical and radiologic assessments to predict breast cancer pathologic complete response to neoadjuvant chemotherapy. Breast Cancer Res Treat., 92 (3): 231–238.
66. Schneider P., Baldus S., Metzger R. et al. (2005) Histomorphologic tumor regression and lymph node metastases determine prognosis following neoadjuvant radiochemotherapy for esophageal cancer: implications for response classification. Ann. Surg., 242: 684–692.
67. Schneider P., Metzger R., Schaefer H. et al. (2008) Response evaluation by endoscopy, rebiopsy, and endoscopic ultrasound does not accurately predict histopathologic regression after neoadjuvant chemoradiation for esophageal cancer. Ann. Surg., 248: 902–908.
68. Shimosato Y., Oboshi S., Baba K. (1971) Histological evaluation of effects of radiotherapy and chemo-therapy for carcinomas. Jpn. J. Clin. Oncol., 1: 19–35.
69. Solbiati L., Livraghi T., Goldberg S.N. et al. (2001) Percutaneous radio-frequency ablation of hepatic metastases from colorectal cancer: long-term results in 117 patients. Radiology, 221 (1): 159–166.
70. Theodoropoulos G., Wise W.E., Padmanabhan A. et al. (2002) T-level downstaging and complete pathologic response after preoperative chemoradiation for advanced rectal cancer result in decreased recurrence and improved disease-free survival. Dis Colon Rectum, 45: 895–903.
71. Therasse P., Arbuck S.G., Eisenhauer E.A. et al. (2000) New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J Natl Cancer Inst, 92 (3): 205–216.
72. Yonemura Y., Kinoshita K., Fujimura T. et al. (1996) Correlation of the histological effects and survival after neoadjuvant chemotherapy on gastric cancer patients. Hepatogastroenterology, 43: 1260–1272.
73. Yuen P.W., Man M., Lam K.Y., Kwong Y.L. (2002) Clinicopathological significance of pi6 gene expression in the surgical treatment of head and neck squamosus cell carcinomas. J. Clin. Pathol., 55 (1): 58–60.
Гістологічна оцінка відповіді пухлини на хіміо-/променеву терапію
О.М. Грабовий, Т.О. Тарасова, М.В. Кошубарова
Національний інститут раку, Київ
Резюме. Оцінка відповіді пухлини на лікування (ВП) є важливим критерієм ефективності хіміо-/променевої терапії та прогнозу онкологічного захворювання. Променеві та клінічні методи, надаючи цінну інформацію, все ж не дають повної характеристики ВП і мають бути доповнені гістологічним дослідженням, яке, окрім детальної оцінки ефективності терапії, значно підвищує достовірність прогнозу. Основним гістологічним параметром при оцінці ВП сьогодні є об’єм пухлинних елементів, що зберегли життєздатність. Однак розуміння того, що для характеристики ВП важлива не тільки оцінка обсягу резидуальних пухлинних елементів, а й інших ознак, змушує дослідників шукати шляхи для створення систем багатофакторного аналізу ВП, придатних для широкого повсякденного використання в медичній практиці.
Ключові слова: відповідь пухлини на лікування, гістологія, лікувальний патоморфоз
Histological evaluation of tumor response to chemo-/radiotherapy
A.N. Grabovoy, T.O. Tarasova, M.V. Koshubarova
National Cancer Institute, Kiev
Summary. Assessment of tumor response to treatment (TR) is an important criterion for the effectiveness of chemo-/radiation therapy and prognosis of oncological disease. Ray and clinical methods, providing valuable information, yet do not give the full characteristics of TR and should be supplemented by histological examination, which in addition to a detailed assessment of the effectiveness of therapy, significantly improves the accuracy of prediction of disease. The main histological parameter in the evaluation of TR today is the amount of viable tumor-treasured items. However, understanding what is important to characterize the TR is not only an estimate of the amount of residual tumor elements, but other features, makes the researchers look for ways to create a multivariate analysis, TR systems are suitable for a wide general use in medical practice.
Key words: tumor response to treatment, histology, treatment pathomorphosis.